




HO—OH HO—OSO3H(过一硫酸)
HO3SO—OSO3H(过二硫酸)( )


 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免
中混入
沉淀,溶液中
(列出算式)时,应停止加入
溶液。
②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量
,可析出
。

①该氧化物为。
②已知: 和
同族,
和
同族。在
与上层
的反应中,
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
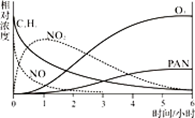
a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2molNO2
①如图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。

②2000℃时,向容积为2L的密闭容器中充入10molN2与5molO2 , 达到平衡后NO的物质的量为2mol,则此刻反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为。
③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:。

例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16gCH4还原NO2至N2 , 共放出热量867kJ,则ΔH2=。若用标准状况下4.48LCH4还原NO2至N2 , 共转移的电子总数为(阿伏加德罗常数的值用NA表示)。
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是,说明氧化性Ag+>Cu2+。
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2 , 黄色沉淀是。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有(填离子符号)。
b.白色沉淀B是。
c.白色沉淀A与AgNO3溶液反应的离子方程式是,说明氧化性Ag+>Cu2+。
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是。
③ 方案2中,Cu2+能氧化I- , 而Ag+未能氧化I-的原因:。
(资料:Ag+ + I- = AgI↓ K1=1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2= 8.7×108)

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
①滴定前是否要滴加指示剂?(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是
①由“黄色立即加深”初步判断有I2生成,选择 (填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式,该条件下氧化性:Fe2+ I2(选填“>”或“<”)。
③实验Ⅱ的目的是。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 (填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ I2(选填“>”或“<”)。
小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。

已知:水解能力:Bi3+>Fe3+。
回答下列问题:
[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]

①当调节pH=2.5时,铋(Bi)的存在形式有。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为。

回答下列问题:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为。
①写出NaBH4的电子式:。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:。

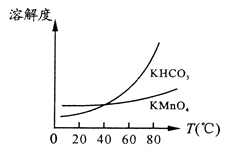
由下图可知,从滤液Ⅲ得到KMnO4需经过、、洗涤等操作。
①电解槽阳极反应式为;
②阳极还可能有气体产生,该气体是。
①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示).
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |