实验目的 | 实验方法或操作 | |
A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 |
C | 判断反应后 | 将 |
D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |

| 实验器材 | 相应实验 | |
| ① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| ② | 烧杯、分液漏斗 | 用饱和 |
| ③ | 量筒、玻璃捧、烧杯、 | 用浓盐酸配制 |
| ④ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
| ⑤ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到 |
| 选项 | A | B | C | D |
| 实验 | | | | |
| 实验目的 | 证明非金属性 | 分离溴苯 | 测定中和热 | 证明 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温 | 盐酸与氢氧化钠的反应为放热反应 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
 B . 保存液溴
B . 保存液溴  C . 分液,先放出水层,再倒出溴的苯溶液
C . 分液,先放出水层,再倒出溴的苯溶液  D . 进行中和热的测定
D . 进行中和热的测定 


 制取乙酸乙酯
B .
制取乙酸乙酯
B .  测定中和热
C .
测定中和热
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  测定醋酸
测定醋酸
 B .
B .  D .
D . 


配制0.50mol/L NaOH溶液
a.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
b.从图中选择称量NaOH固体所需要的仪器是(填字母):.
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
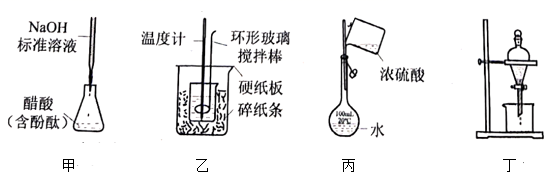
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.

a.写出该反应的热化学方程式(中和热为57.3kJ/mol):.
b.取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
测定50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液中和反应时放出的热量。
采用稍过量的NaOH溶液的原因是。
实验次数 | HCl溶液的体积/mL | 待测 | NaOH溶液的体积/mL |
1 | 27.84 | 25.00 | |
2 | 27.83 | 25.00 | |
3 | 27.85 | 25.00 |
配制250mL0.1032mol·L-1的HCl溶液,必须使用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和。
某实验小组用下图所示装置测定盐酸与NaOH溶液反应的中和热。

仪器B的名称。使盐酸与溶液充分混合的操作是
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.4 | 3.2 |
2 | 26.1 | 26.3 | 26.2 | 29.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.1 | |
近似认为盐酸和
的密度都是
, 中和后生成溶液的比热容
, 中和热
(结果保留至小数点后一位)。
酸碱式滴定管使用时的第一步操作是,除去碱式滴定管胶管中气泡的操作是。
请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |
NaOH | ||||
1 | 25.0℃ | 25.0℃ | 29.1 | |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
用标准的硫酸滴定待测的 溶液时,终点现象是:。

|
测定次数 |
待测 |
|
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/ |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据计算可得该 溶液的物质的量浓度为
(保留四位有效数字)。
第1步:向锥形瓶中加入处理后的水样25.00 , 加入几滴
溶液作为指示剂。
第2步:加入 溶液(过量),充分摇匀。
第3步:用 标准溶液进行滴定,至终点时消耗标准溶液
。
计算该水样中 的物质的量浓度为
(已知:
,
,
)。
取 溶液和30
硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为
溶液和0.50
硫酸溶液的密度都是1
, 中和后生成溶液的比热容
。则计算得中和热
(取小数点后一位)。
a.实验装置保温、隔热效果差
b.用量筒量取 溶液的体积时仰视刻度线读数
c.分多次把 溶液倒入盛有硫酸的小烧杯中
d.用温度计测定 溶液起始温度后直接测定
溶液的温度
|
|
向烧杯中加入的试剂及用量/ |
|
|||||
|
0.1 |
0.1 |
0.1 |
淀粉溶液 |
|
时间/s |
||
|
① |
25℃ |
20.0 |
10.0 |
5.0 |
1.0 |
0.0 |
|
|
② |
40℃ |
20.0 |
10.0 |
5.0 |
1.0 |
0.0 |
|
|
③ |
25℃ |
20.0 |
5.0 |
5.0 |
1.0 |
V |
|
写出混合溶液中滴入溶液反应的离子方程式为。
测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
采用稍过量的NaOH溶液的原因是。
在生成
的反应中,存在如下平衡:
。取两个封装有
和
混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在(填“热水”或“冷水”)中的颜色更深,产生这一现象的原因是。
培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生色的(填化学式)沉淀;铜丝周围的现象是,发生的电极反应式为。


从实验装置上看,图中尚缺少的一种仪器是;
①移取20.00mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
②用标准溶液润洗滴定管2~3次。
③把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
④取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处。
⑤调节液面至“0”或“0”以下刻度,记下读数。
⑥把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,并记下滴定管液面的刻度。
请回答下列问题:
正确的操作步骤的顺序是(填序号)。
滴定次数 | 待测溶液的体积/mL | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 20.00 | 2.34 | 20.39 |
第二次 | 20.00 | 3.20 | 23.20 |
第三次 | 20.00 | 0.60 | 20.80 |

温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.6 | a |
2 | 27.0 | 27.4 | 27.2 | 31.8 | |
3 | 25.9 | 25.9 | 25.9 | 30.3 | |
4 | 26.4 | 26.2 | 26.3 | 31.9 | |
表中的℃。


(i)用量筒量取50 mL 0.5 mo/L的盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表,下问)。 ▲ , 擦干备用。
(ii)用另一个量筒量取50 mL 0.55 mo/L的NaOH溶液,用温度计测量并记录NaOH溶液的温度。
(iii)打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计, ▲ 。密切关注温度变化,将最高温度记为反应后体系的温度。
(iv)重复上述步骤(i)~(iii)两次。
根据实验步骤回答下列问题:
在横线上填写适当的操作,将实验步骤补充完整:
①,
②;
NaOH溶液的浓度略大于盐酸的目的是。
步骤i:量取25.00 mL废水于锥形瓶中,加入适量稀硫酸酸化;
步骤ii:加入过量的碘化钾溶液充分反应:;
步骤iii:向锥形瓶中滴入几滴指示剂。用 式滴定管量取0.1000
溶液进行滴定,数据记录如表:(
)
|
滴定次数 |
|
|
|
第一次 |
1.02 |
19.03 |
|
第二次 |
2.00 |
19.99 |
|
第三次 |
0.20 |
|
步骤 iii中量取溶液选择的是(填“酸”或“碱”)式滴定管或通用型滴定管;

①,
②的含量为
(保留2位小数)
①下列操作顺序是:()→()→()→ A→C→()→()(用序号字母填写)
A.移取20.00 mL待测水样注入洁净的锥形瓶中,并加入2~3滴K2Cr2O7试液
B.重复实验2次
C.把锥形瓶放在滴定管的下面,垫上白纸
D.在清水洗涤后,用标准溶液润洗滴定管2~3次
E.取标准液注入滴定管至刻度线0以上2~3cm,并固定在铁架台上
F.用标准液滴定至溶液出现砖红色沉淀时,停止滴定,并记下滴定管液面的刻度V2
G.排气泡后,记下读数V1
②盛装上述待测液和标准液需要用到的滴定管分别为和 (填“甲”或“乙”)

③下列操作或误差判断正确的是
A.滴定过程中,眼睛始终注视锥形瓶中溶液颜色的变化
B.锥形瓶清洗后需要用待测水样润洗2~3次
C.滴定完成后,俯视滴定管读数,会造成滴定结果偏高
D.若滴定结束发现滴定管中出现气泡,则使结果偏低
④实验数据如下表:
实验次数 | 滴定前读数/mL | 滴定前读数/mL |
1 | 0.10 | 12.22 |
2 | 1.25 | 13.37 |
3 | 0.82 | 14.52 |
则:该水样中Cl-物质的量浓度是mol/L
①移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
②用标准溶液润洗滴定管2~3次;
③取标准NaOH溶液注入滴定管至0刻度以上2~3cm;
④把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液;
⑤调节液面至0刻度或0刻度以下,记下读数:
⑥把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度。

若用25mL滴定管进行实验,当滴定管中的液面在“10”处时,管内液体的体积(填正确答案标号)。
a. =10mL B. =15mL C. <10mL D. >15mL
实验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
i | 25.00 | 0.00 | 19.95 |
ii | 25.00 | 1.10 | 18.30 |
iii | 25.00 | 0.20 | 20.25 |
请计算滴定过程中消耗的V(NaOH)=,待测的盐酸的物质的量浓度为(计算结果保留四位小数)。

回答下列问题:
碎泡沫塑料的作用是;若将A换为“铜丝搅拌棒”测得的将(填“偏大”、“偏小”或“不变”)。
煤油的主要成分为 , 已知
完全燃烧生成气态水时放出1386.2kJ热量;
。则表示煤油燃烧热的热化学方程式为。
①
②
已知。则高炉内
被CO还原为Fe的热化学方程式为。
在锌与稀盐酸的反应中,
(填“>”或“<”或“=”)
| 化学键 | | | | | |
| | 436 | 343 | 1076 | 465 | 413 |
则 生成
放出
热量。

a.用量筒量取
盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取
溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的
稀溶液、
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为
、
、
,则
、
、
的关系为。
①负极的电极反应式为。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为 。