实验 | 结论 | |
A | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2﹣二溴乙烷无色、可溶于四氧化碳 |
B | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
C | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
D | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的一氯甲烷具有酸性 |

| 实验 | 现象 | 结论 | |
| A | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+ , 没有Fe3+ |
| B | 将红热的木炭投入浓硫酸中产生的气体通入澄清的石灰水 | 石灰水变浑浊 | 木炭被氧化成CO2 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,再滴加0.1mol/L KI溶液 | 先有白色沉淀生成,后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |

选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液 | 溶液变红 | 待测溶液中含有Fe2+ |
B | 向KMnO4酸性溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3·H2O能大 量共存 |
D | 向10mL0.1mol·L-1Na2S溶液中滴入2mL0.1 mol·L-1ZnSO4溶液,再加入0.1 mol·L-1CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
已知:在溶液中.FeSO4+NO [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法错误的是( )
 制取二氧化氮
B .
制取二氧化氮
B .  制取氨
C .
制取氨
C .  制取氯气
D .
制取氯气
D .  制取乙酸乙酯
制取乙酸乙酯
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断错误的是( )

①通入氮气的目的是。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是。
④样品完全分解后,装置A中的残留物含有 和
,检验
存在的方法是:。
①称量 样品于锥形瓶中,溶解后加稀
酸化,用
溶液滴定至终点。滴定终点的现象是。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
溶液滴定至终点,消耗
溶液
,该晶体中铁的质量分数的表达式为。
向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.
针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
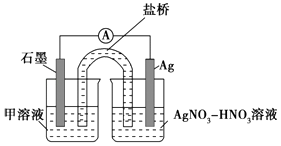
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是,操作现象是.
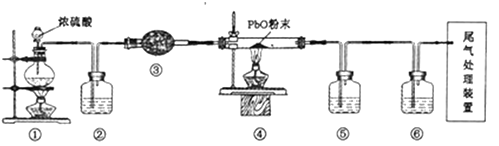
为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
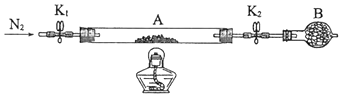
①仪器B的名称是.
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
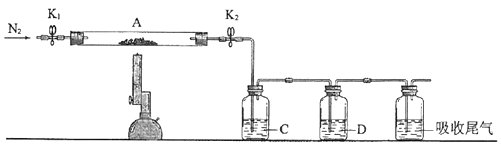
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为.
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式.
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol•L﹣1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol•L﹣1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol•L﹣1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+![]() Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+![]() CuI↓(白色)+I2 .
CuI↓(白色)+I2 .
①用稀硫酸证实沉淀中含有Cu+的实验现象是.
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ .

a.白色沉淀A是BaSO4 , 试剂1是.
b.证实沉淀中含有Cu+和SO32﹣的理由是.
已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和.
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:

步骤二:(按图形式呈现).
b.假设ii成立的实验证据是

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
装置甲玻璃仪器名称为;装置乙中反应的离子方程式为。
某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是(填方案编号)。

|
实验步骤 |
预期现象 |
结论 |
|
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份; |
|
固体残留物仅为Fe2O3 |


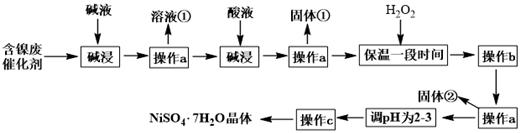
已知:Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15

已知:①NO2沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生水解。
回答下列问题:
a. A→ D → C → F → B → F →E
b. A→ C → D → F → B → F →E
c. A→ F → C → D → F → B →E
d. A→ F → D → C → F → B →E
将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
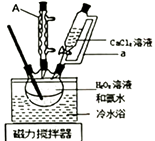
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1 , 则样品中CaO2的质量分数为%。
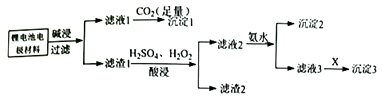
已知:溶解度表:
Li2CO3 | LiOH | LiI | |
0℃ | l.54g | 12.7g | 151g |
100℃ | 0.72g | 13.6g | 179g |
回答下列问题:
a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2 , 节约药品更环保

已知:
①硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl− , 可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是,实验现象是。

取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3− , 理由是。欲证明实验Ⅱ所得溶液中存在IO3− , 改进的实验方案是。
③ 实验Ⅱ中反应的离子方程式是。
ⅰ. Br2 +H2O HBr +HBrO;
ⅱ.;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+。
①用化学方程式表示生成改副产物的原因:。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再,直到尿素完全转化。
③常用硫脲除去LiBrO3 , 反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 , 选用硫脲除杂的优点是;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是。

Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
|
实验序号 |
实验操作 |
现象 |
结论 |
|
① |
加入几小块CaCO3固体 |
有气泡产生 |
Ⅰ或Ⅱ |
|
② |
滴加少量淀粉KI溶液,振荡 |
|
Ⅲ |
|
③ |
滴加少量溴水,振荡 |
|
Ⅱ |
|
④ |
滴加少量酸性KMnO4溶液,振荡 |
溶液呈紫色 |
|

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果(填“偏高”、偏低”或“不变”)。
请简述理由:。
)溶液X中一定大量含有的金属阳离子是,简述如何检验溶液X中该离子。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
(填仪器名称)中;滴定终点的现象为。
②气体Y中SO2的物质的量分数为。


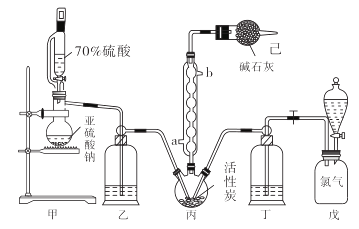
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

![]()
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
①55℃蒸发结晶; ②趁热过滤; ③;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl- , 将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是;
②所称取的样品中NaClO2的物质的量为(用含c、V的代数式表示)。
 试剂X为。
试剂X为。
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为。 |
若溶液变蓝 | ②证明红色固体肯定含有,可能含有。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量 |

量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
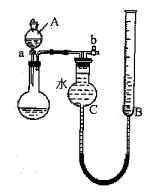
①仪器A的名称是。
②读数前,应进行的操作是。
③该方案存在较大的误差,可能的一种原因是。
a.Na2SO3溶液
b.双氧水
c.硝酸钠溶液
d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式。
③该方案中,操作I包含的操作名称依次为。

②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为 mol ·L-1。
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2 , 发生的离子反应为。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONaNaCN。(填“>”、“<”或“=”)

①常温时醋酸的电离常数为1.96×10-5 , 0.10 mol·L-1CH3COOH溶液中c(H+)=mol·L-1。
②在①所示的溶液中溶质为
③在①和②所示溶液中c(CH3COO-)-c(CN-)(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。