选项 | 操作和现象 | 结论 |
A | 常温下将打磨过的铝片放入浓硝酸,无明显现象 | 常温下铝与浓硝酸不反应 |
B | 将蘸取了某溶液的玻璃棒进行灼烧,火焰呈黄色 | 该溶液中含有钠元素 |
C | 用玻璃棒蘸取浓硫酸滴在纸上,纸变黑。 | 浓硫酸具有脱水性 |
D | 向淀粉溶液中加入稀H2SO4 , 加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
|
|
|
|
A.除去 | B.比较Al和Cu的金属活动性 | C.检验溴乙烷消去反应的产物 | D.分离饱和 |
选项 | 探究方案 | 探究目的 |
A | 向试管中滴入几滴1-溴丁烷,再加入2mL5%NaOH溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴2%AgNO3溶液,观察现象 | 检验1-溴丁烷中的溴元素 |
B | 向盛有4mL0.1mol•L-1KBr溶液的试管中加入1mL新制氯水,振荡,观察溶液颜色变化 | Cl2的氧化性比Br2强 |
C | 室温下,比较等物质的量浓度的NaF溶液和NaClO溶液pH的相对大小 | Ka(HF)>Ka(HClO) |
D | 向盛有5mL0.005mol•L-1FeCl3溶液的试管中加入5mL0.015mol•L-1KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化 | 反应物浓度影响化学平衡 |
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有 | 产生有臭鸡蛋气味的气体 | 酸性:硫酸>硫化氢 |
B | 将 | 混合气体颜色变浅,饱和食盐水进入到试管中 |
|
C | 常温下,用胶头滴管吸取某盐溶液滴在pH试纸中央,然后与标准比色卡对比 | 试纸颜色与标准比色卡中pH=7的颜色相同 | 该盐属于强酸强碱盐 |
D | 镀铜铁的镀层破损后,浸泡在盐酸中一段时间,加入几滴KSCN溶液 | 溶液未显血红色 | 说明整个过程无Fe(Ⅲ)生成 |
编号 | 实验目的 | 实验方案 |
A | 检验蔗糖是否发生水解 | 直接向水解后的溶液中加入新制氢氧化铜并加热,观察现象 |
B | 探究氯乙烷是否含有氯元素 | 取2mL氯乙烷样品于试管中,加入5mL20%KOH的溶液并加热,冷却到室温后向试管中滴加 |
C | 比较次氯酸和醋酸酸性强弱 | 用pH计测量相同浓度 |
D | 探究金属钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水,观察是否有气体生成 |
编号 | 1 | 2 | 3 |
实验 |
|
|
|
现象 | 溶液变为黄绿色,产生白色沉淀(白色沉淀为CuSCN) | 溶液变红,向反应后的溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多 | 接通电路后,电压表指针不偏转。一段时间后,取出左侧烧杯中少量溶液,滴加K3[Fe(CN)6]溶液,没有观察到蓝色沉淀 |
下列说法错误的是

选项 | 实验操作 | 现象 | 结论 |
A | 在苯酚溶液中滴加少量溴水 | 没有明显现象 | 苯酚与溴不反应 |
B | 在鸡蛋清溶液中加入饱和Ba(NO3)2溶液 | 有沉淀生成 | 蛋白质发生盐析 |
C | 用pH计测定同浓度的NH4F溶液和NaClO溶液的pH | 后者pH较大 | |
D | 在I2的CCl4溶液中加入浓KI溶液,振荡 | 四氯化碳层紫红色变浅 | I2在四氯化碳中的溶解度小于在KI溶液中的溶解度 |

选项 | A | B | C | D |
目的 | 配制100mL 0.1mol·L-1的硫酸 | 除去氯气中的HCl气体 | 由FeCl3溶液制取FeCl3固体 | 判断2NO2(g) |
实验 方案 |
|
|
|
|
选项 | 实验操作和现象 | 实验结论 |
A | 向溶有 | X具有强氧化性 |
B | 向0.1 | 氧化性: |
C | 向 |
|
D | 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性 | 溴乙烷发生了消去反应 |
A.制取乙烯 | B.探究浓度对反应速率的影响 | C.检验乙炔具有还原性 | D.制取 |
|
|
|
|
选项 | 实验目的 | 实验现象 | 结论 |
A | 探究有机物中官能团之间的影响 | 分别向丙烯酸乙酯和 | 氰基活化双键,使其更易发生加聚反应 |
B | 比较 | 向酸性 | 氧化性: |
C | 纤维素水解实验 | 将脱脂棉放入试管中,滴入 | 纤维素未发生水解 |
D | 探究不同价态硫元素之间的转化 | 向 |
|
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有3.0mL无水乙醇的试管中加入一小块金属钠 | 缓慢产生气泡 | 乙醇分子中羟基氢的活泼性小于水分子中的氢 |
B | 向盛有2.0mL甲苯的试管中加入3滴酸性 | 紫色褪去 | 甲苯中含有碳碳双键,可被酸性 |
C | 向含有少量 | 产生白色沉淀 | |
D | 用玻璃棒蘸取 | 试纸先变蓝,后褪色 |
|
实验目的 | 实验药品 | |
A | 比较水和四氯化碳分子的极性 |
|
B | 验证乙醇的消去产物乙烯 | 乙醇、酸性高锰酸钾溶液、浓硫酸 |
C | 探究温度对化学平衡的影响 |
|
D | 证明牺牲阳极法保护铁 | Fe、Zn、酸化的食盐水、 |
选项 | 实验目的 | 实验操作 |
A | 制备并收集 | 加热试管中的 |
B | 证明 | 向双氧水中通入 |
C | 检验淀粉是否完全水解 | 向淀粉溶液中滴加稀硫酸,充分加热一段时间后,加入过量氢氧化钠溶液,再滴入几滴碘水 |
D | 证明酸性:苯酚<碳酸 | 将盐酸与碳酸氢钠混合产生的气体直接通入苯酚钠溶液中 |
选项 | 实验操作和现象 | 结 论 |
A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
B | 将KI和FeCl3溶液在试管中混合后,加入CCl4 , 振荡,静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
D | 将0.1mol•L﹣1 , MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L﹣1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
选项 | 实验操作 | 现象 | 结论 |
A | 将KI和H2O2溶液在试管中混合后,加入苯萃取,振荡,静置 | 上层溶液呈紫红色 | 氧化性:H2O2>I2 |
B | 将刚刚用砂纸打磨过的铝箔放在酒精灯上加热 | 铝箔熔化,但不滴落 | 铝易被氧化;铝的熔点比氧化铝低 |
C | 常温下,用pH试纸测量某浓度的NaHSO3溶液的pH | pH约为5.5 | 该溶液中的HSO3﹣的电离程度大于它的水解程度 |
D | 向盛Mg(OH)2悬浊液的试管中加入适量NH4Cl浓溶液 | 溶液变澄清 | Mg(OH)2与NH4Cl溶液发生氧化还原反应 |
选项 | 实验目的 | 操作 | 现象 |
A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
C | 比较非金属性:Br>I | 将溴水滴加到KI﹣淀粉溶液中 | 溶液变蓝 |
D | 检验某溶液中是否含有SO42﹣ | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
A | B | C | D |
|
|
|
|
证明温度对平衡移动的影响验证 | 实现了化学能与电能相互转化 | 验证铁钉发生吸氧腐蚀 | 制备少量的氧气 |
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
实验目的 | 实验操作 | |
A | 鉴别Al3+和Fe3+ | 分别加入少量NaOH溶液 |
B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |

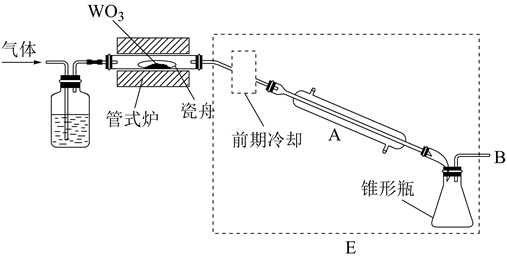
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO
+Ba(IO3)2=BaWO4+2IO
;交换结束后,向所得含IO
的溶液中加入适量酸化的KI溶液,发生反应:IO
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
=2I-+S4O
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。


中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。

① ,合适反应温度为
;副反应:
。
②常压下, 沸点
,熔点
;
沸点2.0℃,熔点
。
③ ,
在
中的溶解度远大于其在水中的溶解度。
请回答:

②将上图中装置组装完整,虚框D中应选用。

针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→→→e→d→f→。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和 转入分液漏斗
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
实验数据如下表:
| 加入量 | |
| 滴定Ⅰ测出量 | |
| 滴定Ⅱ测出量 | |
①用标准 溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是。
②高纯度 浓溶液中要求
(
和
均以
计)。结合数据分析所制备的
浓溶液是否符合要求。

①实验任务。通过测定溶液电导率,探究温度对 溶解度的影响。
②查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时, 。
③提出猜想。
猜想a:较高温度的 饱和溶液的电导率较大。
猜想b: 在水中的溶解度
。
④设计实验、验证猜想。取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的 饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/ |
| 1 | Ⅰ:25℃的 | 25 | |
| 2 | Ⅱ:35℃的 | 35 | |
| 3 | Ⅲ:45℃的 | 45 | |
⑤数据分析、交流讨论。25℃的 饱和溶液中,
。
实验结果为 。小组同学认为,此结果可以证明③中的猜想
成立,但不足以证明猜想
成立。结合②中信息,猜想
不足以成立的理由有。
⑥优化实验。小组同学为进一步验证猜想 ,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表中内容。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/ |
| 4 | Ⅰ |
| |
| 5 |
|
| |
⑦实验总结。根据实验1~5的结果,并结合②中信息,小组同学认为猜想 也成立。猜想
成立的判断依据是。
步骤I. 的制备
 步骤Ⅱ.产品中
步骤Ⅱ.产品中 含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
;
④平行测定三次, 平均值为22.45,
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
| 温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| | 11.9 | 15.8 | 21.0 | 27.0 | |||
| | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
 C .
C .  D .
D . 
已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;具有较强的还原性。
②合成原理:在℃条件下,
。