反应II:CO2(g)+H2(g) CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)ΔH3=—90.7kJ·mol-1
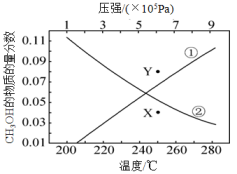
下列说法正确的是( )

|
压强 |
温度/℃ |
NO达到所列转化率需要时间/s |
||
|
50% |
90% |
98% |
||
|
1.0 |
30 |
12 |
250 |
2830 |
|
90 |
25 |
510 |
5760 |
|
|
8.0 |
30 |
0.2 |
3.9 |
36 |
|
90 |
0.6 |
7.9 |
74 |
|
根据表中数据,下列说法正确的是( )


①可以循环使用的物质是(写化学式)。
②理论上,过程Ⅲ中消耗氧气时,过程Ⅰ中吸收
的物质的量是
。
反应ⅰ:
反应ⅱ:
在催化加氢制取甲醇的反应体系中,两个反应同时进行,则下列说法错误的是( )
容器 | T/℃ | n/mol | t/min | ||||||
0 | 30 | 60 | 90 | 120 | 150 | 180 | |||
甲 | T1 | n(NO2) | 2.00 | 1.50 | 1.10 | 0.85 | a | 0.80 | 0.80 |
乙 | T2 | n(NO2) | 2.00 | 1.60 | 1.25 | 1.00 | 0.80 | 0.65 | 0.65 |


①m的值为多少?
②A在5 min末的浓度。
③B的平衡转化率。
④该反应的平衡常数。
a.二甲醚和水蒸气的体积比等于1︰1
b.容器中压强保持不变
c.υ正(H2)=4υ逆(CH3OCH3)
d.容器中一氧化碳的物质的量不再改变
a.将H2O(g)从体系中分离出来
b.缩小容器体积,使体系压强增大
c.加入合适的催化剂
d.升高体系温度

①T℃时,在状态Ⅰ的条件下,反应达到C点时体系处于平衡状态,以H2表示该反应的平均速率υ(H2)=,CO的转化率是,反应的平衡常数KⅠ=。
②若仅改变某一条件,测得H2物质的量随时间变化如图状态Ⅱ所示,则KⅠKⅡ(填“>”、“<”或“=”)。
③若仅改变某一条件时,测得H2的物质的量随时间变化如图状态Ⅲ所示,则改变的条件可能是。
实验序号 | 实验温度/K | 往烧杯中加入的试剂及其用量 | 溶液颜色褪至无色所需时间/s | ||||
酸性 |
| ||||||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | |
B | 2 | 0.02 | 3 | 0.1 | 8 | ||
C | 313 | 2 | 0.02 | 0.1 | 1 | ||
草酸与高锰酸钾反应的离子方程式为。
下列操作会使所测得的高锰酸钾的纯度偏低的是____(填字母)。
某兴趣小组取适量固体进行下面实验:

①向固体中加入少量水时,溶液呈绿色的原因是:;
②取少量蓝色溶液加热后,溶液变为绿色,则0;(填“>”、“<”或“=”)
③另取少量蓝色溶液滴加几滴浓盐酸,溶液颜色变为。
b.为黄色沉淀,且溶解度比
小很多。

①ⅰ中蓝色变深,说明加入饱和
溶液后,平衡移动。(填“正向”、“逆向”或“不”)
②ⅱ中蓝色变浅,用平衡移动解释其原因为。
③ⅲ中出现色沉淀,静置后溶液颜色与ⅳ相比更。(填“深”或“浅”)

CO2(g)+H2(g)CO(g)+H2O(g) ΔH1=+41.5kJ·mol-1
一定压强下,按照一定比例投入原料,CO2的平衡转化率在300℃以下随温度升高而减小,在300℃以上随温度升高而增大,甲醇的产量在300℃以下随温度升高而减小,在300℃以上随温度升高基本不变,理由是。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)⇌CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) ⇌CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) | △H3 | K3 | |||

|
|
NO |
CO |
N2 |
CO2 |
| △fH
|
91.0 |
-110.5 |
0 |
-393.5 |
| S
|
210.8 |
198.0 |
190.0 |
213.8 |
①已知当ΔH-T·ΔS<0 [T为热力学温度,T(K)=273.15+t(℃)]时,反应能自发进行。则上述尾气净化反应能够自发进行的温度范围是(忽略温度变化对各物质的焓H、熵S的影响)。
②常压下,将体积比1:1混合的NO和CO以一定流速通过两种不同催化剂(Cat.1和Cat.2)进行反应,测量流出气体中NO含量,得出尾气脱氮率α(NO)随反应温度变化的曲线,如图所示。下列说法不正确的是。

A.该反应正反应的活化能小于逆反应的活化能
B.使用Cat.1时,NO的转化率随温度升高而不断增大
C.相同条件下该反应在使用Cat.2时的反应热小于使用Cat.1时的反应热
D.700℃为Cat.2的最佳活性温度,温度升高,催化剂可能失活

①T1(填“>”“<”或“=”)T2。
②由曲线可知:恒温恒压条件下,当投料比
等于化学计量数之比时,φ(NH3)有最大值。请在图中画出T1温度下,恒容密闭容器中,平衡时NH3体积分数φ(NH3)随反应物投料比
变化曲线。