实验 | 实验操作和现象 |
1 | 用pH试纸测得0.1mol·L-1NaHCO3溶液的pH约为8 |
2 | 向0.1mol·L-1NaHCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液,产生白色沉淀 |
3 | 向0.1mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液 |
4 | 向浓NaHCO3溶液中加入浓Al2(SO4)3溶液,有气体和沉淀生成 |
下列说法不正确的是( )
试剂 | pH | ||
初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
①1LH2O | 7 | a | 12 |
②0.10molCH3COOH,0.10molCH3COONa配制成1L的溶液 | 4.76 | 4.67 | 4.85 |
已知:缓冲作用是维持溶液自身pH值的相对稳定。
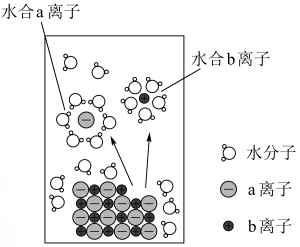

已知:或
;a、b、c、d、e分别表示
、
、
、
、
中的一种。
。

下列说法错误的是

a.c(H+) b.c(OH-) c. d.
名称 | 醋酸 | 氢氟酸 | 草酸 |
化学式 | HF | ||
电离平衡常数 |
三种酸的酸性由强到弱的顺序为(填化学式)。

①稀释前(填“>”“=”或“<”)。
②a、b两点:(填“>”“=”或“<”)。
某学生实验记录数据如下:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | NaOH | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
近似认为的NaOH溶液和
的盐酸的密度都是
, 中和后生成溶液的比热容
, 则中和热
(取小数点后一位)。

亚磷酸可由PCl3水解而成,H3PO3溶液存在电离平衡: H3PO3H++H2PO,H2PO
H++HPO
, 回答下列问题:
①Na2HPO3属于(填“正盐”或“酸式盐”)。
②常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示的是曲线(填“I”或“Ⅱ”),亚磷酸(H3PO3)的Ka2=。

|
弱酸 |
NH3·H2O |
HNO2 |
H2CO3 |
H3PO4 |
|
电离平衡常数(25℃) |
Kb=1.8×10-5 |
Ka=5.0×10-4 |
Ka1=4.0×10-7 Ka2=5.0×10-11 |
Ka1=8.0×10-3 Ka2=6.0×10-8 Ka3=2.0×10-13 |
①向溶液中加入少量的
溶液反应的离子方程式是。
②的
溶液中离子浓度大小关系是。
H2C2O4 | H2CO3 | HNO2 |
Ka1=5.6×10-2 Ka2=1.5×10-4 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=5.6×10-4 |
回答下列问题:
滴定次数 | 滴定前酸性KMnO4溶液的读数/mL | 滴定后酸性KMnO4溶液的读数/mL |
1 | 0.10 | 20.30 |
2 | 0.50 | 20.80 |
3 | 0.00 | 22.00 |
4 | 1.10 | 21.20 |
①KMnO4溶液应盛装在(填“酸式”或“碱式”)滴定管中,原因为。
②达到滴定终点时的标志为。
③c(H2C2O4)= mol∙L-1。
中C元素的化合价是,写出
的电离方程式。

①三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解,
是一种稳定的配离子,能类似于
中的
在溶液中稳定存在。
和
存在如下平衡:
ⅰ.
ⅱ.
②相同条件下,草酸根(C2O)的还原性强于
③为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
操作 | 现象 |
在避光处,向10mL 0.5 | 得到翠绿色溶液和翠绿色晶体 |
取实验中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,原因是(结合ⅰ、ⅱ平衡,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与
结合使ⅱ平衡移动(填“正向”或“逆向”)。经检验发现上述实验中
和
未发生氧化还原反应。

①由此可知溶液呈(填“酸性”或“碱性”)
②写出在水中存在的两个平衡:ⅰⅱ。
这两个平衡程度的大小关系是:ⅰⅱ。(填“<”或“>”)
其中甲同学设计图1装置(盐桥中为KCl),闭合开关后灵敏电流计指针发生偏转。

①通过验证新产物也可以帮助确认正、负两极,验证电源正极生成物的实验操作方法是。
②闭合开关后盐桥中的移向(填“左”或“右”)侧的烧杯。
③负极的电极反应。
④乙同学按图2操作,并没有出现预期的现象,而是溶液很快呈红色。大约30mm后红色变为橙色,5小时后变为黄绿色。
因此,乙认为刚开始一段时间并不涉及氧化还原反应。
查阅资料:溶液中、
、
三种微粒会形成一种组成为
的“配合物”并存在转化关系:
请从反应速率和平衡的角度解释原因。
(i)SO2(g)+V2O5(s) SO3(g)+V2O4(s),活化能为Ea1。
(ii)2V2O4(s)+O2(g) 2V2O5(s),活化能为Ea2。
能量变化如图所示。

总反应2SO2(g)+O2(g) 2SO3(g)的
kJ∙mol−1 (用E1~E5中的合理数据组成的代数式表示)。决定SO2催化氧化的总反应速率的是步骤(填(i)或(ii)),其活化能为 kJ∙mol−1 (用E1~E5中的合理数据组成的代数式表示)。
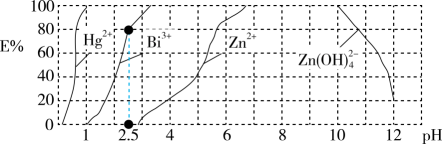
①25℃时,Na2SO4溶液的pH(填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1 , 求硫酸第二步电离的电离常数(写出计算过程,结果保留三位有效数字)。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是。若保持温度不变,关于该所得溶液,下列说法正确的是。
A.加入少量冰醋酸,c()与c(
)均减小
B.加入少量H2SO4 , H2SO4的电离程度增大
C.加入少量NaAc固体。c()与c(
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小

已知:①不考虑水电离出的和
及
和
与水发生的反应;
②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
①相同状况下,。
②P点溶液中,(用含x的代数式表示)。
①“”段发生反应的离子方程式为。
②向原B等份的溶液中通入
后,所得溶液中的溶质为(填化学式),其质量之比为。
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是( )
|
化学式 |
电离平衡常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |