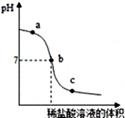


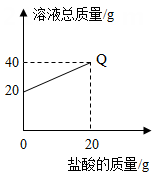
 B .
B . 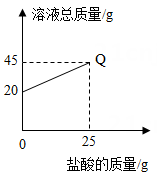 C .
C . 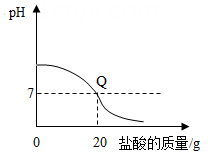 D .
D . 


老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
反应时间/s | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
滴入稀盐酸体积/mL | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
温度/℃ | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
。
,原因是。
②Si(粗)+2Cl2 SiCl4
③SiCl4+2H2 Si(纯)+4HCl
其中反应①属于(填“复分解”或“置换”)反应.
⑴制皮蛋所需的原料有:生石灰、纯碱、草木灰(含K2CO3)等。
⑵禽蛋长时间放置,蛋白中的部分蛋白质会分解成氨基酸,它能跟碱性物质作用生成不溶于蛋白的氨基酸盐。
请你结合所学知识为小烁解惑。




①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
锥形瓶 | 锥形瓶+稀盐酸 | 锥形瓶+反应后溶液 | |
质量(克) | 35.5 | 55.5 | 80.5 |
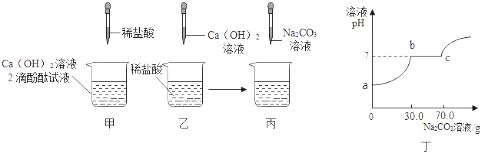
名称 | Ca(OH)2 | NaOH |
价格(元/千克) | 6.00 | 24.00 |
某化学小组初步探究“氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况”.
实验用品:37%的浓盐酸(密度为1.18g/mL)、10%的氢氧化钠溶液、蒸馏水、量筒、温度计
实验步骤
(1)计算:需要37%的浓盐酸的体积为 mL(精确到0.01mL,下同);需要蒸馏水的体积为 mL(水的密度为1.0g/mL)
(2)量取浓盐酸和蒸馏水.
(3)混合配制.
加入盐酸的体积(V)/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度变化(△t)/℃ | △t1 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
(1)表中△t1的值为 .
(2)试绘出溶液温度变化与加入盐酸体积之间的关系图 .
(3)根据所绘曲线分析,加入盐酸的体积在0~10mL时,溶液温度变化的趋势及其原因是 .
(4)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素).
横坐标及猜想理由: ;
纵坐标及猜想理由: .

【实验操作】用试管取6毫升氢氧化钡溶液,往试管中加入6毫升稀盐酸,等分成两份。
①将另一份混合液加入甲试管中;
②乙试管中加入3mL同浓度稀盐酸和3mL蒸馏水;
③向两试管中分别加入等量且足量的锌,并迅速套上气球。
能证明原混合液的盐酸中H参加了反应的现象是。
【提出问题】反应后所得溶液中溶质是什么?
【提出猜想】化学兴趣小组同学根据上述实验现象,一致认为反应后溶液中的溶质(除酚酞溶液外)一定有;
【设计方案】小红经过认真分析,认为反应后所得的溶液中还可能存在硫酸,并针对自己的猜想,设计了下列两种实验方案:
|
实验方案 |
实验步骤 |
预期现象 |
结论 |
|
方案1 |
取样,滴入适量的硝酸钡溶液 |
出现白色沉淀 |
有硫酸 |
|
方案2 |
取样,滴入盛有锌粒的试管中 |
有气泡产生 |
有硫酸 |
【反思评价】小组同学仔细研究上述两种实验方案后,认为方案1无法验证小红猜想的正确性,理由是;
【拓展迁移】大家讨论后,按正确方案进行操作,确认了溶液中有硫酸存在,由此可知,在分析化学反应结束后所得物质的成分时,除了要考虑到生成物外,还有考虑到。

①往一定量的稀盐酸中逐滴滴加氢氧化钠溶液,烧杯中溶液温度变化如图乙所示。请 判断 A 点时溶液的酸碱性为性。
②若改为将等量稀盐酸往氢氧化钠固体中滴加,反应过程中最高温度远高于图乙中的最高值。请做出合理解释。。
【提出问题】反应后溶液中的溶质是什么?
【假设猜想】经分析,大家一致认为,反应后的溶液中一定含有的一种溶质是X.
甲组同学的猜想如下:猜想一:只有X;猜想二:有X和HCl; 猜想三:有X和NaOH;
【实验探究】
【实验拓展】小炬同学使用了与碳酸钠不同类别的药品,也设计了一种方案验证猜想二成立。她的方案是:取烧杯中的少量溶液于试管中,加入则证明猜想二成立。(要求填写出药品名称以及出现的现象)
【资料】无水硫酸铜遇到水或水蒸气变蓝色,空气中有水蒸气。

【设计实验】如下图所示,取甲、乙、丙三支洁净的试管,向甲试管中加入无水乙酸和无水硫酸铜,向乙试管中加入氢氧化钠固体和无水硫酸铜,向丙试管中加入无水乙酸、氢氧化钠固体和无水硫酸铜,并将试管内的试剂充分混合。
【实验反思】

在烧杯中加入约 5mL 氢氧化钠溶液,滴入几滴酚酞溶液,再向溶液中滴加稀盐酸,至溶液全部变成无色。
【提出问题】反应中氢氧化钠和盐酸恰好完全中和吗?
【作出猜想】大家针对反应后溶液中所含溶质的成分作出了如下猜想:
猜想一:只含有 NaCl;
猜想二:含有 NaCl 和 NaOH;
猜想三:含有 NaCl 和 HCl。
实验方案编号 | 实验一 | 实验二 | 实验三 |
实验操作 | 用镊子夹取一片 pH 试纸, 浸入烧杯的溶液里,片刻后取出,把试纸显示的颜色与标准比色卡比较 | 用试管取样品溶液约 1mL,滴加AgNO3 溶液 | 用试管取样品溶液约1mL,滴加Na2CO3 溶液 |
实验现象 | pH=2 | 产生白色沉淀 | —— |
实验结论 | —— | 溶液中有 HCl | 溶液中有 HCl |
【评价与反思】经过分析,同学们认为实验中存在两处明显错误:
①实验操作中的错误是。
②实验方案中也有一个是错误的,错误的原因是。
|
加入盐酸的体积V/mL |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
测得溶液温度t/℃ |
15.2 |
19.6 |
22.0 |
26.0 |
28.2 |
26.7 |
25.7 |
24.7 |
23.7 |
22.9 |

①根据酸碱反应的表格数据描述温度随着稀盐酸量增加的关系
②猜想温度变化的原因并加以解释
若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究酸碱反应是否放热”,此提议是否合理?为什么?
稀硫酸溶液体积(mL) | 0 | 2 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
温度 (℃) | 20 | 20.5 | 24 | 24.8 | 25.2 | 24.3 | 23.6 | 21 | 20 |
分析以上数据,氢氧化钠完全反应时消耗的稀硫酸溶液的体积是mL;一段时间后,温度降低的原因是.
(如果你能正确回答下列问题,你将得到4分奖励,但本卷总分不超过60分)
方法一:;方法二:.