

| 实验 序号 | 金属质量/g | 金属状态 | | | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |

3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2molW,若测得以Z浓度变化来表示的化学反应速率为0.01mol/(L·min),则上述反应中Z气体的化学计量数n的值是( )
①v(A)=1.5mol/(L·min)
②v(B)=0.08mol/(L·s)
③v(C)=1.5mol/(L·s)
④v(D)=4.0mol/(L·min)
| | 0 | 20 | 40 | 60 |
| | 0.200 | 0.100 | 0.050 | 0.025 |
下列说法错误的是( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | | | | |
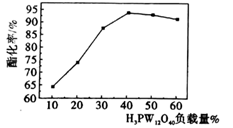

| t/min | 0 | 2 | 4 | 8 |
| V(O2)/mL | 0 | 22.4 | 33.6 | 36.4 |
下列说法正确的是( )(忽略溶液的体积变化)
|
实验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4mol•L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中: V2=,V6=,V10=。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
|
实验序号 |
实验温度/K |
参加反应的物质 |
溶液颜色褪至无色时所需时间/s |
||||
|
KMnO4溶液(含硫酸) |
H2C2O4溶液 |
H2O |
|||||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
|||
|
A |
293 |
2 |
0.02 |
4 |
0.1 |
0 |
6 |
|
B |
T1 |
2 |
0.02 |
3 |
0.1 |
V1 |
8 |
|
C |
313 |
2 |
0.02 |
V2 |
0.1 |
1 |
t1 |

①
②
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:

① 下,5min内该反应的平均反应速率
②若不考虑催化剂的影响,5min时 下和
下逆反应速率较快的为
填“
”或“
”
,原因为
|
实验 编号 |
室温下,试管中所加试剂及其用量/mL |
室温下溶液颜色褪至无色所需时间/min |
|||
|
0.6mol·L-1H2C2O4溶液 |
H2O |
0.2mol·L-1KMnO4溶液 |
3mol·L-1稀硫酸 |
||
|
1 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
|
2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
|
3 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
请回答:
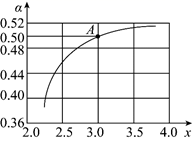
一定能判断该反应达到化学平衡状态的是_______。
① 三种溶液中的c(H+)大小关系为。
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为。
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为。
④ 若取等质量相同状态下的Zn分别跟这三种溶液反应,反应速率大小关系为。
① 三种酸的物质的量浓度大小关系为。
② 取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积大小关系为。
③ 若取等质量Zn分别跟这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为。