|
阳离子 |
阴离子 |
||
|
…… |
NO3- |
Cl- |
|
|
…… |
…… |
…… |
…… |
|
Cu2+ |
…… |
★ |
溶 |
|
Ag+ |
…… |
溶 |
不 |
| 序号 | 实验目的 | 实验方案 |
| A | 区分氢氧化钠溶液和氢氧化钙溶液 | 取样品,加入碳酸钠溶液 |
| B | 用pH试纸测定溶液的酸碱性 | 将pH试纸进入待测液体 |
| C | 探究稀盐酸和氢氧化钠溶液是否完全反应 | 向反应后溶液中加入硝酸银溶液 |
| D | 除去氢氧化钠溶液中的碳酸钠 | 滴加稀盐酸,直到刚好无气泡产生 |
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )



 B .
B .  C .
C .  D .
D . 
①氢气 ②纯碱 ③熟石灰 ④碳酸氢铵 ⑤硫酸钾 ⑥烧碱(氢氧化钠)



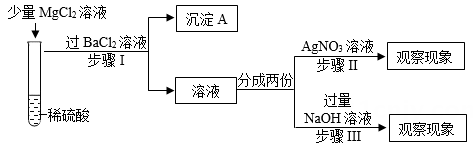
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀和滤液.
②向所得固体中加入足量稀硝酸,白色沉淀全部溶解,且有气泡产生.
③向所得滤液中加入稀硫酸,有白色沉淀生成。
据此推断,
猜想1:没有发生复分解反应,溶液中有MgCl2 , 即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]

【猜想与假设】甲同学猜想:Na+、Cl-、CO32-
乙同学猜想:Na+、Cl-、CO32-、SO42-
你的猜想是: (写出一种即可)

[提出问题]两者是否发生了化学反应?
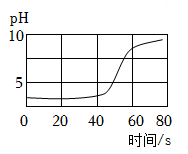
[实验探究]将盛有上述实验混合液的试管标为①,如图甲。
小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7。于是得出结论: 。
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2mL,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论。
[反思评价]小军认为小敏在实验设计中存在不够严密的地方,请帮他指出:。
[交流讨论]试管③中的溶液中有哪些溶质?同学们分析了两位同学的实验过程,一致认为没有H2SO4 , 其理由是。在此基础上,同学们提出了二种推理;
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理。(选填1或2)



|
Na2CO3溶液质量/g |
5 |
20 |
30 |
40 |
50 |
60 |
70 |
|
沉淀质量/g |
0 |
1 |
m |
3 |
4 |
5 |
m |
①表格中m、n的数值分别为、;
②加入5gNa2CO3溶液充分反应后,滤液中的溶质有(填化学式) ;