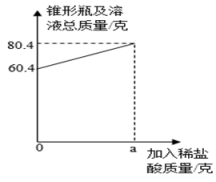
|
滴管甲 |
烧杯① |
滴管乙 |
烧杯② |
|
|
试剂 |
H2O |
NaOH固 体 |
稀盐酸 |
Na2CO3 |
请分析气球前后两次变化的原因


|
沉淀物 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
1.9 |
4.2 |
9.1 |
|
完全沉淀 |
3.2 |
6.7 |
11.1 |

a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)

老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题。


方法一:判断混合后反应物是否存在。
方法二:判断混合后生成物是否存在。
【提出问题】该溶液中的溶质含有哪些成分?
【查阅资料】CaCl2溶液呈中性。
猜想II:溶液中的溶质有CaCl2和HCl;
猜想III:溶液中的溶质有CaCl2和Ca(OH)2。
用符号或文字表示酸碱中和反应的实质:。为了验证哪一个猜想是正确的,同学们做了以下实验。
|
实验操作 |
实验现象 |
实验结论 |
|
①取少量反应后的溶液于试管中,滴加 酚酞试液 |
|
猜想Ⅲ不正确 |
|
②再另取少量反应后的溶液于另一支试管中,向 里面加入适量CaCO3 |
有气泡生成 |
猜想正确 |
A.CuO B.AgNO3 C.Cu D.NaOH
反应的化学方程式为。
【查阅资料】

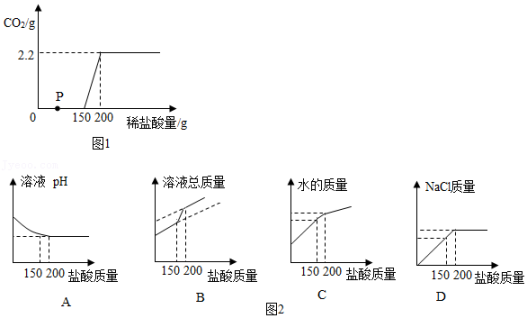
①盐酸和Na2CO3溶液反应是分步进行的,即:
反应1:Na2CO3+HCl=NaCl+NaHCO3 (先)
反应2:NaHCO3+HCl=NaCl+H2O+CO2↑ (后)
②碳酸氢钠与碳酸钠均呈碱性,氯化钙溶液呈中性。
③碳酸氢钠与氯化钙溶液不反应。
【开展实验】
|
实验步骤 |
实验现象 |
|
步骤Ⅰ:取少许待测溶液于一支试管中,加入过量的CaCl2 , 溶液 |
产生白色沉淀 |
|
步骤Ⅱ:取步骤1中上层清液于另一试管中,滴加无色酚酞溶液 |
溶液呈红色 |
①小科依据现象得出无明显现象的试管中发生了“反应1”,请你说明观察到实验现象为什么能支持小科的结论。。
②为了完成探究目的,步骤Ⅰ中的CaCl2溶液还可以用代替。
实验1:用pH试纸测试滤液pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填“实验 1”或“实验 2”)
取样品10克,得到如下A、B两组数据:请回答下列问题:

|
反应前 |
完全反应后 |
|
|
A组 |
玻璃管和氧化铜样品的质量共42.5克 |
玻璃管和固体物质的质量共40.9克 |
|
B组 |
U形管和其中物质的质量共180.0克 |
U形管和其中物质的质量共182.3克 |
②二氧化碳的制取和收集;③氧气的制取和收集。考查规定由学生抽签确定考题。


请根据流程图回答:操作Ⅰ的名称是;试剂B的化学式:。

已知:①该装置气密性良好,A、C、D中所装药品足量且能完全吸收相关物质
②碱石灰是CaO与NaOH的固体混合物
③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:
2NaHCO3 Na2CO3+H2O+CO2↑探究过程如下:
Ⅰ.称量样品和已装入相关药品的装置C、D的质量,分别为:m、m1、m2;
Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热
Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷却
Ⅳ.再次称量装置C、D的质量,分别为m3、m4
请回答下列问题
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2;
小明认为废液中溶质是CaCl2和HCl
【查阅资料】CaCl2溶液呈中性;Ca(OH)2微溶于水
【实验与结论】小红从废液缸中取少许上层清液(下称“废液”),滴入1-2滴无色酚酞试液,酚酞试液不变色。
小明也取少许废液,向其中加入少量的氧化铜粉末,充分反应,看到的现象是溶液从无色变为蓝色,化学反应方程式是,
综上所述,结论:的猜想是正确的.
在交流与讨论后,小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是.
A.只看到有大量气泡冒出 B.只有白色沉淀析出
C.开始出现白色沉淀,后冒气泡 D.开始冒气泡,后出现白色沉淀
久置的氢氧化钠固体的成分有下面3种可能情况:
猜想一:只有氢氧化钠
猜想二:
猜想三:只有碳酸钠
|
实验方案 |
实验现象 |
结论 |
|
称取m克固体放入试管中,加蒸馏水完全溶解,然后滴加足量的BaCl2溶液 |
|
猜想一不成立 |
为了进一步验证是猜想二还是猜想三成立,活动小组的同学们又提出了一个定量实验方案。实验如下:将反应后的物质过滤、洗涤、干燥,称得沉淀的质量为ng(忽略操作过程中物质的损失)。若猜想二成立,则n的取值范围是 。
氢氧化钠暴露在空气中容易变质,其主要原因是 (用化学方程式表示),因此实验室中氢氧化钠固体必须密封保存。
【猜想与假设】猜想1:白色固体是Ca(OH)2

猜想2:白色固体是CaCO3猜想3:白色固体是
【实验探究】同学们设计了不同的方法验证猜想。
甲同学:取少量样品加水,充分振荡,发现溶液中大量固体不溶解,则证明CaCO3的存在。
乙同学:取少量样品加水,充分振荡,静置后加入无色酚酞试液,试液变红,证明Ca(OH)2的存在。丙同学:取少量样品加入足量稀盐酸,观察到气泡产生,证明CaCO3存在。
请指出以上方法中不合理的是哪位同学,并说明理由。
【进一步探究】丁同学取1克样品与足量的稀盐酸反应,实验装置如图1所示,测量生成气体的体积(气体不溶于植物油)如图2所示。已知在该实验条件下,生成气体的密度为2g/L,计算样品中Ca(OH)2的质量分数为。
|
探究目的 |
探究步骤 |
预计现象 |
|
除尽溶液中的CO32- |
①取少量溶液于试管中,滴加足量的试剂 |
有白色沉淀产生 |
|
证明溶液中尚存NaOH |
②向实验①所得溶液中滴加酚酞试液 |
|

①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;@向上述3个烧杯中分别加入3份质量不同的样品;
②充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
|
实验一 |
实验二 |
实验三 |
|
|
反应前稀盐酸+烧杯质量(克) |
150 |
150 |
150 |
|
反应前固体样品质量(克) |
4 |
8 |
12 |
|
反应后烧杯内物质+烧杯质量(克) |
m |
155.8 |
158.7 |

性质一:2NaHCO3=Na2CO3+CO2↑+H2O,(NaHCO3在50℃以上开始逐渐分解)
性质二:NaHCO3+HCl=NaCl+H2O+CO2↑

(反应化学方程式:K2CO3+2HCl=2KCl+H2O+CO2↑)

|
实验 |
甲 |
乙 |
丙 |
丁 |
|
加入稀盐酸的质量/g |
50 |
50 |
50 |
50 |
|
加入样品的质量/g |
5 |
10 |
15 |
20 |
|
生成CO2的质量/g |
1.76 |
3.52 |
m |
4.40 |
求: