





|
选项 |
实验目的 |
实验方法 |
相关解释 |
|
A |
测量氯水的pH |
|
pH试纸遇酸变红 |
|
B |
测量锌粒和3mol/L硫酸反应生成 |
|
|
|
C |
探究正戊烷 |
|
|
|
D |
用 |
|
|

已知:①沉淀时与pH的关系
pH | ||
开始沉淀 | 3.68 | |
沉淀完全 | 5 |
②溶解度
溶解度 | NaCl | |
100℃ | 95.1g | 39.8g |
25℃ | 4.6g | 36g |
回答下列问题:

如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Zn2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 6.2 | 8.1 |
| 完全沉淀的pH | 2.8 | 8.3 | 8.0 | 8.2 | 10.1 |
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有(填化学式)。


①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液;“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | In3+ | Ga3+ | Cu2+ | Zn2+ | Pb2+ |
开始沉淀的pH | 2.2 | 2.1 | 2.6 | 4.6 | 6.24 | 7.1 |
完全沉淀(c=1.0×10-5mol·L-1)的pH | 3.2 | 3.4 | 4.3 | 6.6 | 8.24 | 9.1 |
HClO+H++2e-=Cl-+H2O φ=1.49+lg
AuCl4-+3e-=4Cl-+Au φ=0.994+lg
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是。

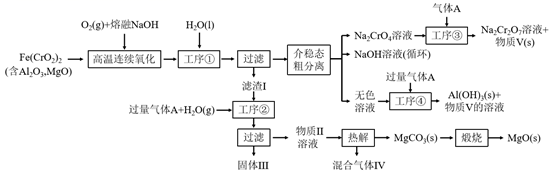
回答下列问题:

该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全(c=1.0×10*mol-L')的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
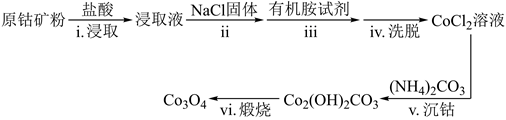
已知:①在含一定量Cl-的溶液中:Co2++4Cl-=CoCl
②CoCl 溶于有机胺试剂,Co2+、Cr3+和Ni2+不溶于有机胺试剂;有机胺试剂不溶于水。
③Ksp[Co(OH)2]=1.0×10-15

已知:①BiOCl难溶于水;
②“浸铋”所得浸取液中含BiCl3、AsCl3等物质。
回答下列问题: