
选项 | 劳动项目 | 化学知识 |
A | 工人将模具干燥后再注入熔融钢水 | 铁与水蒸气高温下会反应 |
B | 用墨汁绘制国画 | 常温下碳单质性质稳定 |
C | 用含NaOH和Al粉的管道疏通剂疏通厨卫管道 | NaOH与Al粉反应放热产生大量气体,且NaOH有一定腐蚀性 |
D | 用富含淀粉的谷物酿酒 | 淀粉水解生成乙醇 |
选项 | 现象 | 化学知识 |
A | 工厂将模具干燥后再注入熔融钢水 | 铁与水高温下会反应 |
B | 开发高端耐腐蚀镀铝钢板 | 铝能形成致密氧化膜 |
C | 石蜡油加强热产生的气体使溴水褪色 | 气体中含有饱和烃 |
D | 氧化铝用于制作耐高温材料 | 氧化铝熔点高 |
| 选项 | 劳动项目 | 化学知识 |
| A | 用小苏打做蛋糕膨松剂 | Na2CO3与酸反应产生气体 |
| B | 将新切土豆丝浸没在水里防止变色 | 土豆中的氧化性物质遇空气变色 |
| C | 煮豆浆点卤水制作豆腐 | 胶体聚沉 |
| D | 用铁质槽罐车运输浓硫酸 | 常温下,浓硫酸和铁不反应 |
选项 | 劳动项目 | 化学方程式 |
A | 家务劳动:巧用食醋除水垢 | 2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O |
B | 社区服务:学习用小苏打烘焙糕点 | NaHCO3+HCl=NaCl+H2O+CO2↑ |
C | 工厂参观:工业生产漂白粉 | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
D | 自主探究:用含铝粉和氢氧化钠的疏通剂疏通管道 | 2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ |
| 选项 | 实验 | 现象 | 结论 |
| A | 相同温度下,用 | 测 | 相同温度下 |
| B | 取 | 溶液不变红 | 反应后固体中可能含有 |
| C | 将湿润的淀粉- | 试纸变蓝 | 该气体为 |
| D | 将少量 | 溶液呈血红色 | |
实验 | 现象 | 结论 | |
A | 向1mL FeCl3溶液中滴加1mLKI溶液,再加入1mLCCl4 , 振荡后静置。 | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
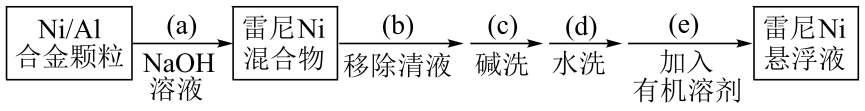
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
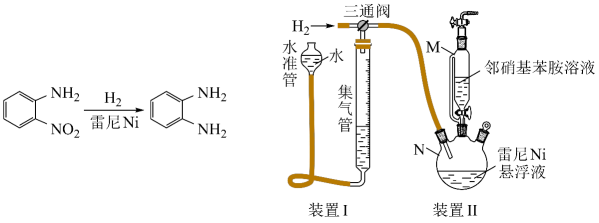
回答下列问题:


已知:①金属镍(Ni)常温难以被氧气氧化;
②瑞尼镍孔隙会吸附大量氢气而活化,活化的瑞尼镍接触空气易自燃。
实验步骤如下:
I.制取瑞尼镍:在烧杯中加入浓NaOH溶液,在冰水浴中分批加入铝镍合金(1:1),不断搅拌,充分反应后,分离得到瑞尼镍,保存于无水乙醇中。
II.用如图装置(夹持、搅拌及加热装置省略)制取氢化肉桂酸,步骤如下:

①检查装置气密性,往三颈烧瓶中加入ag肉桂酸、一定量乙醇和I中制得的瑞尼镍。
②通过反复抽气与充气将装置内空气替换成氢气,关闭K3、K2 , 打开K1 , 充入氢气至储氢筒充满氢气,……
③搅拌并加热三颈烧瓶,充分反应后分离出氢化肉桂酸。
回答以下问题:

回答下列问题:
 回答下列问题:
回答下列问题:
|
开始沉淀的pH |
完全沉淀的pH |
|
|
Ni2+ |
6.2 |
8.6 |
|
Fe2+ |
7.6 |
9.1 |
|
Fe3+ |
2.3 |
3.3 |
|
Cr3+ |
4.5 |
5.6 |
“调pH 1”时,主要除去的离子是,溶液pH范围。
完成下列填空:
;
;
上述反应的最终还原产物为;当有1mol C参加反应时,转移的电子数目为。

a. PO b. H3PO4 c. H2PO


已知:γ-Al2O3能与酸反应,α-Al2O3不与酸反应。
回答下列问题:
①发生上述转化反应的电极应接电源的极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成(填化学式)。

已知:(NH4)2SO4 NH3↑+NH4HSO4
回答下列问题:
![]()
A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液