实验方案 | 现象 | 结论 | |
A | 往 | 短时间内无明显现象 |
|
B | 往 | 溶液先变成血红色后无明显变化 |
|
C | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加 | 溶液呈浅绿色 | 食品脱氧剂样品中没有 |
D | 向沸水中逐滴加5~6滴饱和 | 溶液先变成红褐色再析出沉淀 |
|
单质 氧化物
酸或碱
盐


| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
| 通入 | 褪色 | 褪色 | 褪色 |
| 通入 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
已知: (CuS为黑色固体);
可燃
下列说法错误的是( )
制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
将与液体
混合并加热,制得无水
。已知
沸点为77℃,反应方程式为:
, 装置如下图所示(夹持和加热装置略)。

仪器A的名称为,其作用为。NaOH溶液的作用是。
a. b.
c.
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液

 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免
中混入
沉淀,溶液中
(列出算式)时,应停止加入
溶液。
②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量
,可析出
。

①该氧化物为。
②已知: 和
同族,
和
同族。在
与上层
的反应中,
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
 已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
回答下列问题:

回答下列问题:


已知:LiOH易溶于水,Li2CO3微溶于水。回答下列问题:

已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6
回答下列问题:

①依图判断生成BaS的反应是反应(填“放热”或“吸热”),焙烧温度至少应控制在℃上。某次焙烧在真空容器中进行,1.5h时,测得容器中气体的密度为26.88g/L,该反应的化学反应速率为。
②已知:90℃时BaS的溶解度为50g/100g水,浸取液中还存在三种碱 、
、
,其中碱性最弱的是(填化学式)。浸取液中产生
的原因是。(用离子方程式表示)

①碳化时,先向 溶液中通入(写化学式),写出碳化时发生反应的化学方程式。
②写出检验母液中主要阳离子的实验方案。

回答下列问题:
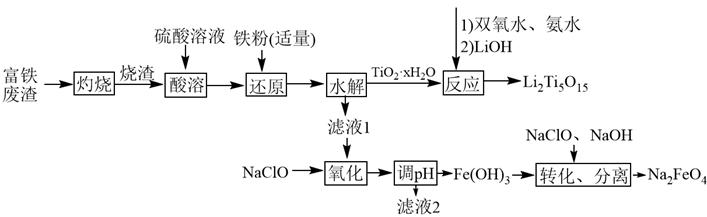
已知: 、
、
,溶液中离子浓度
时认为该离子沉淀完全。回答下列问题:

①滤液Y可循环使用,其主要溶质的质量与反应前的加入量几乎没有变化,该溶质是。解释其质量不变的原因:(用化学方程式表示)。
②Ⅰ和Ⅱ的反应装置均需置于冰水浴中,解释Ⅱ中冰水浴的作用:(答出一点即可)。

ⅰ.按上图连接装置(夹持和加热装置均略去),从水准管口加入适量水,并检查气密性;
ⅱ.准确称量 样品加入试管,并使其在试管底部均匀铺成薄层;
ⅲ.上下移动水准管,使水准管中液面与量气管中液面平齐;读取量气管中液面对应的刻度,记为 ;
ⅳ.加热发生反应: ,充分反应至不再有气体产生,停止加热,;再次读取量气管中液面对应的刻度,记为
;
Ⅴ.计算样品中 的纯度。
①补全ⅳ中操作:。
②该实验条件下,气体摩尔体积为 ,样品中
的纯度为(用质量分数表示)。
实验记录如下:
|
| 实验 | 方案和现象 |
| ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
| ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
| ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
实验iv:
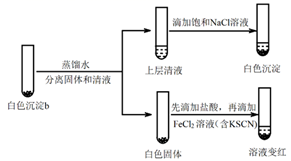
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是。
②FeCl2溶液的作用是。由此判断,白色沉淀b可能含有AgClO。
实验v:
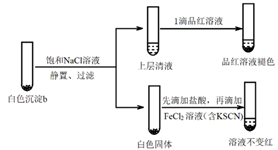
①结合离子方程式解释加入饱和NaCl溶液的目的:。
②推测品红溶液褪色的速率:实验iii比实验v(填“快”或 “慢”)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入 溶液,充分反应后加入
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
| | | | |
| 初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
| 步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
①Fe2+浓度降低,滤渣中存在 。结合离子方程式解释原因:。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、。
① 酸性溶液的作用:。
②结合离子方程式说明MnCO3的作用: 。
①样品中MnCl2的质量分数是(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的 分解。若不加热,测定结果会(填“偏高”、“偏低”或“无影响”)。
试题篮
0