
以下分析不符合事实的是
选项 | 劳动项目 | 化学知识 |
A | 科学研究:燃煤脱硫 | 增大煤燃烧放出的热量 |
B | 工厂生产:冶炼钢铁 | 涉及氧化还原反应 |
C | 社会服务:推广使用免洗手酒精消毒液 | 酒精消毒液酒精能使蛋白质变性 |
D | 家务劳动:饭后用热的纯碱溶液洗涤餐具 | 油脂在碱性条件下发生水解 |

已知:能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:
(水层)
(有机层)
(有机层)
(水层)。下列说法正确的是




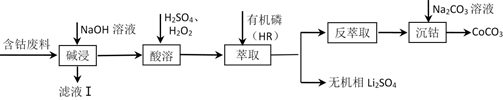
已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是( )

 +2NO
B . CH3ONO中氮氧双键在Pd表面断裂
C . 增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D . 脱附过程2生成了碳酸二甲酯(
+2NO
B . CH3ONO中氮氧双键在Pd表面断裂
C . 增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D . 脱附过程2生成了碳酸二甲酯(  )
)
Ⅰ.用已准确称量的 固体配制一定体积的
标准溶液;
Ⅱ.取 L上述溶液,加入过量
,加
酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用 ![]() 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液
L。
已知:
和
溶液颜色均为无色


已知:
①的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解:气体浓度较大时易发生分解,若用空气、
、氮气等气体稀释时,爆炸性则降低。
②
回答下列问题:
a.减少的分解 b.降低
的溶解度 c.减少
的分解

已知:①Sr(OH)2、Ba(OH)2、Ca(OH)2在不同温度下的溶解度(g):
温度/℃ | 20 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
Ba(OH)2 | 3.89 | 8.22 | 20.94 | 101.4 | — | — |
Ca(OH)2 | 0.173 | 0.141 | 0. 121 | 0.094 | 0.086 | 0.076 |
②浸取时发生反应:2SrS+2H2O=Sr(HS)2+Sr(OH)2 , 硫化锶的溶解度主要受氢氧化锶的溶解度影响。
③BaSO4、SrCO3、BaCO3和SrSO4均难溶于水,在相同温度下的溶解度(S)关系如下:
S(BaSO4)≈S(SrCO3)<S(BaCO3)<S(SrSO4)。
回答下列问题:

①;
②。
①不同条件下,达到相同的平衡转化率,温度越高,所需的压强越大,
0。
②一定压强下,与
的投料比[
]对体系中
平衡转化率的影响如下:

时,解释
平衡转化率随投料比增大而降低的原因:。
①ⅰ.
ⅱ.。
②反应结束后,分离混合物[硫酸(含、
)、S(吸附了
)等],从中获得固体S以及
与
的混合液,便于循环利用。
a.该过程中,应选取的化学试剂是。
b.根据所选取的化学试剂,设计方案,得到S以及与
的混合液。实验方案是:。(用简要文字说明即可)
实验序号 | ⅰ | ⅱ |
所加试剂 |
|
|
| ≈50% | ≈100% |
分析ⅱ中的去除率提高的原因:
a.直接还原
了。
通过计算说明电子得、失数量关系:,证明该原因不合理。
b.研究发现:(导电)覆盖在铁粉表面;随着反应的进行,产生
(不导电),它覆盖在
表面,形成钝化层,阻碍电子传输。
c.能与
反应生成
。
用做同位素示踪实验,证明该原因合理。
d.破坏钝化层。
将ⅱ中的替换为,
的去除率约为50%,证明该原因不合理。
步骤1.取v含氮(
)水样,加入催化剂、
标准溶液(过量),再加入稀
。
步骤2.用标准溶液滴定剩余的
(
被还原为
),终点时消耗
。
已知:
①水样中的含量为
。
②溶液中影响测定。向步骤1中加入适量
, 产生
驱赶
, 否则会使测定结果(填“偏大”或“偏小”)。

回答下列问题:
“反应”步骤中生成的反应中氧化剂与还原剂的物质的量之比为。

已知装置B中的产物有气体和
, 则B中产生
气体的化学方程式为。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
发生还原反应:
发生氧化反应:。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 , 对其产生的原因提出猜想:
猜想1.有氧化性,能被还原为
猜想2.有性,能与
反应产生
猜想3.……
序号 | 实验 | 试剂 | 现象 |
ⅰ |
| a | 生成棕褐色固体,产生大量气泡 |
ⅱ | b | 有少量气泡 | |
ⅲ |
| 有少量气泡 |
ⅲ是ⅱ和ⅰ的对照实验。
①X是。
②a是、b是。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。

回答下列问题:


已知:
i.Sc3+、Ti4+、Fe2+均能与P504(用HR表示)发生络合反应,且机理均为:Mn++nHRMRn+nH+;
ii.金属离子开始沉淀及完全沉淀的pH如表所示:
金属离子 | T14+ | Fe2+ | Sc3+ |
开始沉淀pH | 1.3 | 6.8 | 4.0 |
沉淀完全pH | 2.3 | 9.0 | 5.0 |
回答下列问题:
萃取相比( | 1:10 | 1:15 | 1:20 | 1:25 | 1:30 | 1:35 | 1:40 |
Sc3+的萃取率/% | 90 | 90 | 90 | 85 | 80 | 70 | 60 |
该工序中最适宜的值为1:20,理由为。
草酸钪晶体 | 热分解温度区间(K) | 固体失重百分率(%) | 生成的含钪化合物 |
Sc2(C2O4)3·6H2O(摩尔质量为462 g/mol) | 383~423 | 19.48 | A |
463~508 | 23.38 | B | |
583~873 | 70.13 | Sc2O3 |
化合物A的化学式为;由含钪化合物B转化为Sc2O3时,发生反应的化学方程式为。

已知: Ksp[Co(OH)2]=2 ×10-15 , 请回答以下问题:
