

 B .
B .  C .
C . 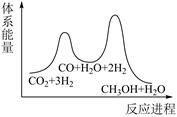 D .
D . 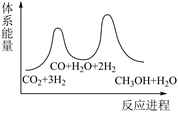


下列判断错误的是( )

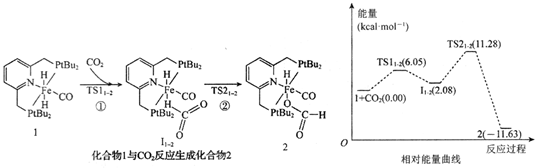

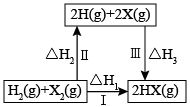
反应①:
反应②:
下列有关说法正确的是( )


| 化学键 | H—H | O=O | O—H |
| E/(kJ·mol-1) | 436 | x | 463 |

曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
①计算当反应生成1.5molCH3OH(g)时,能量变化值是kJ。
②推测反应CH3OH(g)⇌CO(g)+2H2(g)是(填“吸热”或“放热”)反应。
| 时间 | 0 min | 3 min | 6 min | 9 min | 12 min |
| n(CH3OH) | 0 mol | 0.50 mol | 0.65 mol | 0.75 mol | 0.75 mol |
| n(CO2) | 1 mol | 0.50 mol | 0.35 mol | a | 0.25 mol |
①上表中,a为mol。
②由表可知,3~6 min内,v(CO2)=mol·L-1·min-1。
③对于上述反应,下列叙述正确的是。
A.当各气体的浓度不再改变时,该反应一定已达平衡状态。
B.当该反应达到平衡后,。
C.由表可知,3 min时CH3OH的生成速率大于12 min时CH3OH的分解速率。

从循环结果看,能量转化的主要方式是。
请写出表示二甲醚燃烧热的热化学方程式。
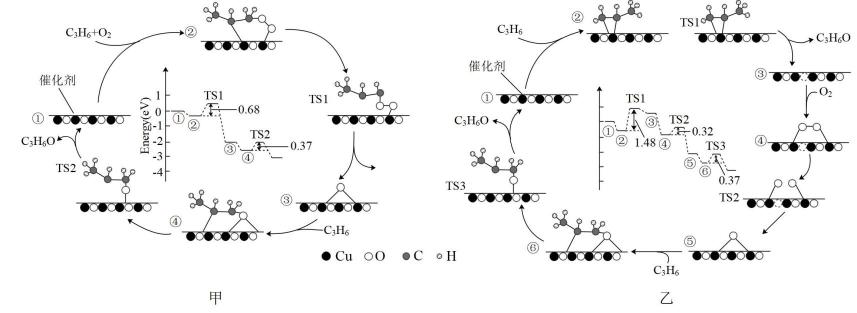
二甲醚水解: 活化能
甲醇与水蒸气重整: 活化能
已知远小于
。在恒温恒容容器内,二甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(
)浓度随时间变化的曲线图。


①表示的曲线为(填“a”或“b”)。
②时M点
逆(填“>”、“<”或“=”)。
③时,CO的平衡转化率为。
|
转化率% |
物质的量/mol |
||
|
|
|
CO |
|
|
50% |
a |
0.1 |
b |
;用平衡分压代替平衡浓度(分压=总压×物质的量分数),计算该条件下反应Ⅰ的压强平衡常数
(用含
的代数式表示)。

①写出再生塔中反应的离子方程式。
②已知某温度下,碳酸的电离平衡常数 ,
, 吸收塔中
溶液吸收一定量
后,溶液的
, 此时
:。
已知:①
②
若将
还原为
, 整个过程中放出的热量为867kJ,则
。
化学键 | ||||
键能/ | 436 | 465 | a | 1076 |
则a=。

①装置中仪器A的作用是;
②本实验采用50mL 0.50盐酸、50mL 0.55
氢氧化钠溶液反应,经三次实验测得反应前后的温差平均值为3.3℃,其密度近似地认为均为1
, 反应后溶液的比热容
。则该实验中盐酸和氢氧化钠溶液反应中和热
为;
③下列操作会导致中和热的测定数值偏大的是(填标号);
a.大烧杯上不盖塑料盖板
b.将强酸强碱换成弱酸弱碱
c.用50mL 0.50盐酸与1.1g NaOH固体进行反应
d.将环形玻璃搅拌棒改成环形铜质搅拌棒
e.使用浓硫酸与氢氧化钠溶液进行反应
④若将反应物改为50mL 0.50稀硫酸与50mL 0.55
氢氧化钡溶液,测得反应热为
, 则
(填“>”或“<”),原因是。

A.镁条与盐酸的反应 B.煤的气化
C.煅烧石灰石 D.铝热反应
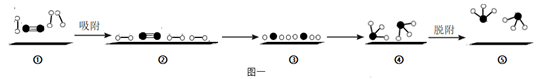
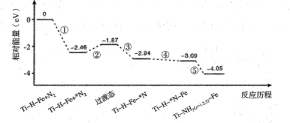
下图是某科研机构利用太阳光,在催化剂表面实现高效分解水来制备氢气的历程,关于该历程,下列说法错误的是____。

Ⅱ.方案二:将与
反应合成甲醇,制备甲醇燃料电池。制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:


科学家可以利用如下图装置,“溶解”水中的二氧化碳,生成电能和氢气,请写出二氧化碳生成氢气的电极反应式。

①
;
②
。
反应的
kJ/mol(用含a、b的代数式表示)。
| 化学键 | N≡N | F—F | N—F |
| 键能/kJ/mol | 946.0 | 157.0 | 283.0 |
①关于反应 , 下列说法中错误的是。
A.过程放出能量
B.反应放出能量
C.使用催化剂能减小反应的
②对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式:。
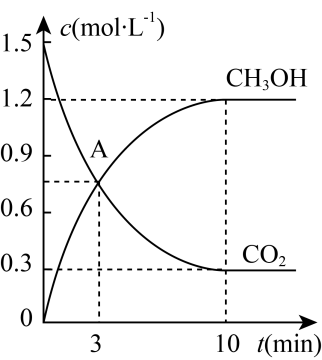
时间 | 0min | 3min | 6min | 10min | 12min |
n(CH3OH)/mol | 0 | 1.5 | 2.1 | 2.4 | 2.4 |
n(CO2)/mol | 3 | 1.5 | 0.9 | a | 0.6 |
回答下列问题:

该反应属于(填“放热”或“吸热”)反应。
已知:该燃料电池的总反应为2CH3OH+3O2+4OH-=2CO+6H2O
①铝片和盐酸反应 ②酸碱中和反应
③晶体与
混合搅拌 ④碳酸钙分解
⑤在
中燃烧 ⑥灼热的碳与
的反应


①从能量转化角度分析,上述原电池将化学能转化为;
②负极的电极材料为;(填化学式)
③正极发生的电极反应;
④若银电极增重5.4g,外电路转移电子的物质的量mol。
