①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol﹣1 .


 (g)
(g) (g)为吸热反应
B .
(g)为吸热反应
B .  (g)
(g) (g)
(g)
物质的量 | 物质 | 完全断键所需吸收的总能量 |
下列说法错误的是

选项 | 实验操作和现象 | 结论或解释 |
A | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,洗涤效果更好 | Fe3++Ag |
B | 将200mL5mol•L-1的Na2CO3溶液加热到60℃,用pH传感器测定pH值,测得溶液的pH值逐渐减小 | Kw改变与水解平衡移动共同作用的结果 |
C | 用注射器多次抽取硫酸厂附近的空气样品慢慢注入盛有品红的同一试管中,品红不变色 | 空气样品中几乎不含SO2 |
D | 取2mL0.5mol/L的CuCl2溶液于试管中,置于冷水中,溶液呈蓝色;一段时间后取出加热,溶液逐渐变黄 | [Cu(H2O)4]2++4Cl- |




|
|
|
|
A.铁件镀银 | B.由褪色快慢研究反应物浓度对反应速率的影响 | C.稀硫酸与锌粒反应制氢气的能量变化 | D.蒸干硫酸铝溶液制无水硫酸铝固体 |

| 选项 | 实验操作和现象 | 实验结论 |
| A | 在小烧杯中滴有少量水,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,用玻璃棒快速搅拌并触摸烧杯外壁,发现烧杯外壁很冷 | Ba(OH)2·8H2O与NH4Cl的反应为吸热反应 |
| B | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | Fe(NO3)2已变质 |
| C | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| D | 向5mL0.1mol·L-1FeCl3溶液中滴入0.1 mol·L-1KI溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,溶液变红 | Fe3+与I-的反应有一定限度 |
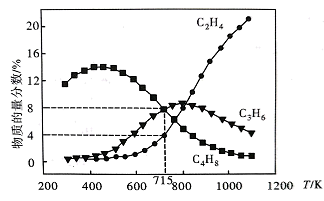
反应I 2CH3I(g)C2H4(g)+2HI(g) ΔH1Kp1=a
反应Ⅱ 3C2H4(g)2C3H6(g) ΔH2Kp2=b
反应Ⅲ 2C2H4(g)C4H8(g) ΔH3Kp3=c
反应I、Ⅱ、Ⅲ在不同温度下的分压平衡常数Kp如表1,回答下列问题:
表1
T/Kp | 298 K | 323 K | 423 K | 523 K | 623 K | 723 K |
反应I | 7.77×10-8 | 1.65×10-6 | 1.05×10-2 | 2.80 | 1.41×102 | 2.64×103 |
反应Ⅱ | 7.16×1013 | 2.33×1012 | 1.48×108 | 3.73×105 | 6.42×103 | 3.40×102 |
反应Ⅲ | 2.66×1011 | 6.04×109 | 1.40×105 | 1.94×102 | 2.24 | 8.99×10-2 |
则Kp4=(用含有b、c的代数式表达),结合表1数据分析 ΔH40。
p/MPa | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
1.42 | 1.75 | 1.98 | 2.15 | 2.30 | 2.42 | 2.53 | 2.63 | 2.72 | 2.80 |
随压强增大不断增大的原因可能是。
②
③
则反应③的。
①下列说法正确的是。
A.使用高效催化剂可以加快化学反应速率,提高和
的平衡转化率
B.时说明反应已经达到化学平衡状态
C.升高温度,化学反应速率加快,说明该反应的正反应是吸热反应
D.恒温恒容下,向平衡体系中再充入适量的 , 平衡正向移动,平衡常数不变
E.恒温恒容下,再加入氨气压强增大可以提高和
的平衡转化率
②已知:催化剂并不是所有部位都有催化作用,真正起催化作用的那些部位称为活性点位,也称活性中心。恒温恒容条件下发生反应 , 若
不变时,
过多,反应速率减慢,可能的原因是。
③若一定温度范围内该反应的化学平衡常数为K,与
(温度的倒数)的关系如图所示:则
0(填“大于”或“小于”)

④时,在体积为
的刚性容器充入
和
合成甲醇,假设只发生反应:
, 5分钟末达到平衡,测得
的体积分数为
, 求5分钟内的平均反应速率
,
的平衡转化率为。
⑤的沸点由高到低的顺序是,原因是。
① (标准
反应)
②(慢速
反应)
③(快速
反应)
④(副反应)
计算反应③的。
 B .
B .  C .
C .  D .
D . 

a.气体密度 b.气体总压 c.CH3OH与O2体积比 d.O2的体积分数

反应②为反应(选填:放热或吸热)。55~100℃时,O2的物质的量浓度随温度升高而增大的原因是。

完成下列填空:
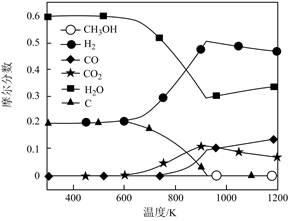
甲醇蒸汽重整制氢过程中有以下化学反应。
|
编号 |
反应 |
方程式 |
△H/kJ·mol-1 |
|
R1 |
甲醇蒸汽重整 |
CH3OH(g)+H2O(g) | △H1=+49.24 |
| R2 | 甲醇分解反应 | CH3OH(g) | △H2 |
| R3 | 水汽反应 | CO(g)+H2O(g) | △H3=-41.17 |
| R4 | 积碳反应 | CO(g)+H2(g) | △H<0 |
| CO2(g)+2H2(g) | △H<0 | ||
| 2CO(g) | △H<0 |
资料:产氢率和水碳比(S/C)的定义:
①产氢率=
②水碳比(S/C)表示反应物中H2O和CH3OH的比值,水碳比的变化是以CH3OH不变,改变H2O的物质的量加以控制。
理想产氢率=。
氨分子中具有较高的含氢量,因此是制氢的优选原料。使用NaNH2非水电解质研究液氨电解制氢原理,装置示意图如图所示。
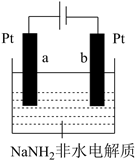
资料:2NH3 NH
+NH
①某电极上发生的电极反应为6NH3+6e-=3H2↑+6NH ,该电极为(选填a或b)极。
②写出另一极上发生的电极反应。
③不考虑其它能量损耗,利用该装置产生1mol氢气时,转移电子的物质的量是mol。
Ⅰ.
;
Ⅱ.
。
①反应Ⅰ和反应Ⅱ中,在热力学上趋势更大的是(填“Ⅰ”或“Ⅱ”),理由为。
②反应Ⅰ的一种溶剂化催化反应历程如图所示(其中TS表示过渡态)。

已知:汽化热指1mol液体变为气体吸收的热量。则HCOOH的汽化热为;下列说法正确的是(填选项字母)。
A.生成TS1的反应步骤为总反应的决速步骤 B.反应过程中的催化剂为
C.溶液中pH能影响反应速率 D.反应过程中Fe的成键数目保持不变
③反应II的催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应而降低积碳量,涉及如下反应:
Ⅲ.
Ⅳ.
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,℃之后,温度升高积碳量减小的主要原因为。

①该反应在(填“较高”或“较低”)温度下能自发进行。
②一定温度下,将一定量充入10L的固定容积容器中发生上述反应,实验测得反应前容器内压强为
kPa,容器内各气体分压与时间的关系如图所示。

6~8min时,反应的平衡常数kPa2;若8min时改变的条件是缩小容器容积,该时刻将容器容积缩小到L,其中
分压与时间关系可用图中曲线(填“
”、“
”、“
”或“
”)表示。
已知:2Li2O(s)+SiO2(s)=Li4SiO4(s) ΔH1=akJ⋅mol-1
Li2CO3(s)+SiO2(s)=Li2SiO3(s)+CO2(g) ΔH2=bkJ⋅mol-1
Li2SiO3(s)=Li2O(s)+SiO2(s) ΔH3=ckJ⋅mol-1
则2Li2CO3(s)+SiO2(s)=Li4SiO4(s)+2CO2(g) ΔH=kJ⋅mol−1(用含a、b、c的式子表示)。
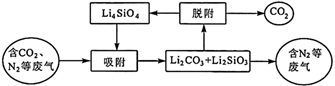
“吸附”过程中主要反应的化学方程式为。
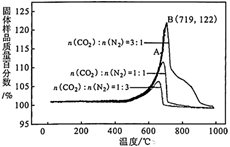
①该反应为反应(填“吸热”或“放热”)。
②A点的v正v逆(填“>”、“<”或“=”),理由是。
③不同CO2的体积分数对于吸附速率的影响是。
④保持B点的温度不变,若所用刚性容器体积为原来的一半,则平衡时理论上c(CO2)较原平衡(填“增大”、“减小”或“不变”)。
⑤B点CO2的吸收率为(保留3位有效数字)。
|
温度/℃ |
200 |
300 |
400 |
|
K |
290 |
39 |
11.7 |
①下列分析正确的是。
a.水煤气变换反应的∆H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2。当其失去吸收能力时,通过加热使吸收剂再生。用化学方程式表示“吸收”、“再生”两个过程:。
|
实验I |
实验II |
|
|
通入气体 |
CO、H2 |
CO、H2、H2O(g) |
|
固体产物 |
Fe3O4、Fe |
Fe3O4 |
结合化学方程式解释H2O(g)的作用:。

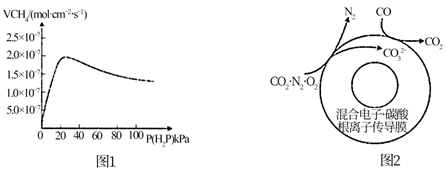
①起还原作用的物质是。
②膜I侧发生的电极反应式是。
③膜I侧所得气体 =3,CH4、H2O、O2反应的化学方程式是。
SMR:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=a kJ·mol-1 K1=1.198×
WGS:CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=b kJ·mol-1 K2=1.767×
回答下列问题:

A.CO2被吸附在MgO的表面而发生反应 B.Pd是反应的催化剂
C.反应过程既有碳氧键的断裂,也有碳氧键的形成 D.反应过程中有CO分子中间体生成
已知:反应前后,溶液的比热容均近似为 、溶液的密度均近似为
,忽略溶液体积、质量变化和金属吸收的热量。请计算: