










可知反应平衡常数K(300℃)K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0 , 根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是。
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。

负极区发生的反应有(写反应方程式)。电路中转移1 mol电子,需消耗氧气L(标准状况)
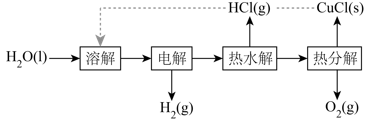
①电解在质子交换膜电解池中进行。阳极区为酸性溶液,阴极区为盐酸,电解过程中
转化为
。电解时阳极发生的主要电极反应为(用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有(填元素符号)。
①实验中发现,在时,密闭容器中
溶液与铁粉反应,反应初期有
生成并放出
, 该反应的离子方程式为。
②随着反应进行,迅速转化为活性
, 活性
是
转化为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为。

③在其他条件相同时,测得Fe的转化率、的产率随
变化如题图所示。
的产率随
增加而增大的可能原因是。

用K2CO3溶液吸收H2S。
已知:氢硫酸和碳酸的电离常数如表。
|
Ka1 |
Ka2 |
|
|
H2S |
1.1×10-7 |
1.3×10-13 |
|
H2CO3 |
4.5×10-7 |
4.7×10-11 |
①用化学用语表示K2CO3溶液显碱性的原因:。
②用过量的K2CO3溶液吸收H2S的离子方程式是。
在密闭容器中发生反应2H2S(g) S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。

①P3>P2>P1 , 反应中S2(填‘“是”或“不是”)气态,理由是。
②实际反应在高温下进行的原因是。
间接电解法脱硫过程的示意图如图。

①溶液X的主要溶质是。
②简述在电解反应器中FeCl3溶液再生的原理:。
③不考虑其他副反应,理论上5molH2S反应能生成gH2。
Mn在(填“阳极”或“阴极”)生成。
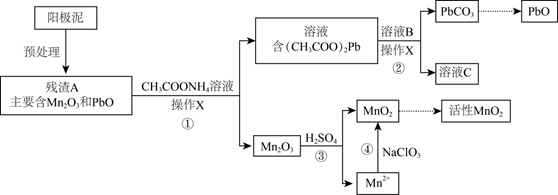
已知:(CH3COO)2Pb在水中难解离。
操作X为。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是。
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
+2
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=[M(MnO2)=87g·mol-1]。
①常温常压下,已知反应的能量变化如图1、图2所示, 由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH= a kJ·mol-1 , 则a=。

②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2和3molH2 , 进行上述反应。 测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=;能使平衡体系中增大的措施有(任写一条)。

①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)HCOOH(g) K=2。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=k正。
②温度为T2℃时,k正=1.9k逆 , 则T2℃时平衡压强(填“>”“<”或“=”)T1℃时平衡压强,理由是。


已知:①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表:
金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
萃取率(%) | 0 | 99 | 0 | 97~98.5 |
②当溶液中剩余离子的浓度小于10-5mol·L-1时,视为沉淀完全。
③MOCVD:化学气相沉积,以合成的三甲基镓为原料,使其与NH3反应得到GaN。
请回答下列问题:

则ZnC2O4·2H2O分解是反应(填“放热”或“吸热”),分解的总化学方程式为。

已知: 25℃时相关物质的Ksp如下表:
物质 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
Ksp | 5×10-18 | 5×10-17 | 1×10-38 | 2× 10-13 | 2×10-20 |
回答下列问题:
a.混合气体密度不变
b.容器内压强不变
c.2v正(H2S)=v逆(CS2)
d.CH4与H2的物质的量分数之比保持不变

①图中表示CH4、H2变化的曲线分别是。
②M点对应温度下,CH4的转化率约为(保留3位有效数字)。950℃时,该反应的Kp=(以分压表示,分压=总压×物质的量分数)。
③维持N点温度不变,向容器内再通入CH4、H2S、CS2、H2各0.1mol,此时速率关系为v正v逆(填“大于”“小于”或“等于”)。



相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:

中国提出要实现“二氧化碳排放力争于2030年前达到峰值,争取在2060年前实现碳中和”的目标,二氧化碳的资源化利用对实现碳中和目标具有促进作用。

①M点时,。(填“>”、“<”或“=”)
②下列叙述中一定能说明该反应达到平衡状态的是。
A.化学反应速率关系:
B.容器内混合气体的密度不再改变
C.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
D.容器内混合气体的平均摩尔质量不再改变
写出C与反应生成
的热化学方程式。
煤焦 | 元素分析/% | 比表面积 | |
C | H | ||
80.79 | 2.76 | 105.69 | |
84.26 | 0.82 | 8.98 | |
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:的脱除主要包含吸附和化学还原(
)两个过程]

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内对NO的脱除率比
的高,可能原因是。(答两条)。
②后,随着温度升高,单位时间内NO的脱除率增大的原因是。

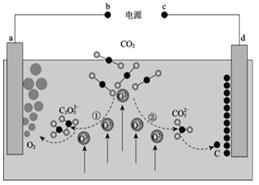
①从A口中出来的物质的是。
②写出电解池阴极的电极反应式。