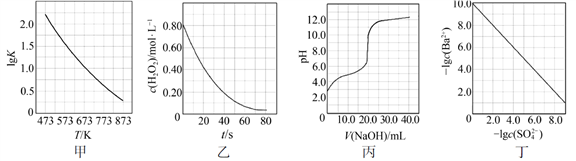
|
选项 |
实验目的 |
实验及现象 |
结论 |
|
A |
比较CH3COO-和 |
分别测浓度均为0.1mol·L-1的CH3COONH4 和NaHCO3溶液的pH,后者大于前者 |
Kh(CH3COO-)〈Kh( |
|
B |
验证蔗糖水解产物 |
向盛有1mL 20%蔗糖溶液的试管中滴入3-5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入银氨溶液 |
有银镜产生 |
|
C |
探究氢离子浓度对 |
向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 |
增大氢离子浓度,平衡向生成 |
|
D |
比较AgCl和AgI的溶度积常数 |
向NaCl、NaI 的混合液中滴加2滴0.1mol/LAgNO3溶液,振荡,沉淀呈黄色 |
Ksp (AgI)<Ksp( AgCl) |

t/s | 0 | 50 | 100 | 150 |
c(N2O5)/mol·L-1 | 4.00 | 2.5 | 2.00 | 2.00 |
下列有关说法错误的是
⑴实验Ⅰ:配制溶液和
溶液。各取
混合(忽略反应引起的溶液体积变化,下同),测得平衡时
浓度为
。
⑵实验Ⅱ:将溶液、
溶液与
水混合,测得平衡时
浓度为
。
下列分析正确的是
|
压强/MPa 平衡常数 温度/℃ |
1.0 |
1.5 |
2.0 |
|
300 |
a |
b |
16 |
|
516 |
c |
64 |
d |
|
800 |
160 |
f |
g |
|
编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
|
|
|
|
||
|
I |
|
0.40 |
0.16 |
0.16 |
|
II |
|
0.20 |
0.09 |
0.09 |
下列说法错误的是
容器1 | 容器2 | 容器3 | |
反应温度(℃) | 400 | 400 | 500 |
起始量 | 1mol | 2mol HI | 1mol |
平衡浓度 | |||
平衡转化率 | |||
平衡常数 |
下列各项关系错误的是







| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )

图中,表示C2H4、CO2变化的曲线分别是、。CO2催化加氢合成C2H4反应的ΔH0(填“大于”或“小于”)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
顺﹣1,2﹣二甲基环丙烷和反﹣1,2﹣二甲基环丙烷可发生如图1转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数.回答下列问题:
完成下列填空:
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
[CO2]/mol•L﹣1 | [H2]/mol•L﹣1 | [CH4]/mol•L﹣1 | [H2O]/mol•L﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为.
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5
0.1mol/LNa2CO3溶液的pH0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是.若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是.(选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]


①压强p1、p2、p3中,最大的是。
②p1=0.5MPa,A点的平衡转化率为,压强平衡常数Kp=。


①当加入量
时,锌的最终回收率下降的原因是(用离子方程式表示),该反应的平衡常数为。{已知
的
}
②“深度除铜”时加入量最好应选(填字母)。
A. B.
C.
D.

①图a纤锌矿型晶体中
的配位数为。
②闪锌矿型中填入
所形成的“正四面体”空隙中,闪锌矿晶胞中含有个“正四面体”空隙。
③图b闪锌矿型晶胞密度为 , 则
与
的距离为nm。(设
为阿伏加德罗常数的值)
①
②
的结构式为,C、H、O三种元素的原子半径由小到大的顺序为。
下列说法正确的是
a.将炭块粉碎,可加快反应速率
b.混合气体的密度保持不变时,说明反应体系已达到平衡
c.平衡时的体积分数可能大于
反应Ⅰ:
反应Ⅱ:
化学键 | ||||
键能 | 436 | 1071 | 464 | 803 |
②若K1、K2分别表示反应Ⅰ、反应Ⅱ的平衡常数,则的平衡常数K=(用含K1、K2的代数式表示)。
③已知的正反应速率
( k为正反应的速率常数),某温度时测得数据如下:
1 | 0.02 | 0.01 | |
2 | 0.02 | 0.02 | a |
则此温度下表中a=。



①
。
②为提高平衡转化率,控制温度范围在(填标号),理由是。
A. B.
C.
D.
以上
①、
时,测得
、
, 则
。
②时,计划在
内转化率达
, 应控制初始浓度
大于
。

①图中表示的曲线是(填“a”“b”“c”或“d”)。
②时,该反应的
(以分压表示,分压
总压
物质的量分数)。
③相比以硫磺矿为原料,使用的优点是,缺点是。
物质 | HBr(g) |
|
|
|
相对能量/ | x | y | z | w |
此温度下,在恒容密闭容器中充入4mol HBr(g)和1mol O2(g)发生“氧化”,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出热量为Q kJ,则下列关系正确的是____(填标号)。
容器体积V/L | 10 | 3 | |
m | 0.09 | 0.25 |
当容器体积从10 L缩小到3
L时,测得此时容器内仅有四种气态组分,平衡移动(填“正向”“逆向”或“不”),m=;容器体积缩小到
L时,平衡移动(填“正向”“逆向”或“不”)。T K时,此反应在容积为10
L和
L时化学平衡常数分别为
、
, 则
(填“大于”“小于”或“等于”)。

a点对应的压强为;b点对应的反应条件为,此时(保留三位有效数字)。

已知:①水溶液中铟主要以In3+的形式存在。
②In3++3HXInX3+3H+
回答下列问题:

In3+(aq)+3H2O(I) In(OH)3(aq)+3H+(aq),则该反应的化学平衡常数
K=(计算结果保留两位有效数字,常温下Kap[ In(OH)3]=1.3×10-37)。