反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )

容器 | n(CO2)/mol | n(C)/mol | n(CO)/mol |
甲 | 0.2 | 0.6 | 0 |
乙 | 0.4 | 0.8 | 0 |
丙 | X<0.6 | 1 | 0 |
Ⅰ.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g)2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

已知:有效转化率=×100%
下列说法错误的是
|
压强/MPa 平衡常数 温度/℃ |
1.0 |
1.5 |
2.0 |
|
300 |
a |
b |
16 |
|
516 |
c |
64 |
d |
|
800 |
160 |
f |
g |
甲 | 乙 | 丙 | 丁 | |
c(H2)/(mol•L-1) | 0.01 | 0.02 | 0.01 | 0.02 |
c(I2)/(mol•L-1) | 0.01 | 0.01 | 0.01 | 0.01 |
c(HI)/(mol•L-1) | 0 | 0 | 0.02 | 0.02 |
下列判断错误的是
容器1 | 容器2 | 容器3 | |
反应温度(℃) | 400 | 400 | 500 |
起始量 | 1mol | 2mol HI | 1mol |
平衡浓度 | |||
平衡转化率 | |||
平衡常数 |
下列各项关系错误的是

t/s | 0 | 20 | 40 | 60 | 80 |
n(N2O4)/mol | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
n(NO2)/mol | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
下列说法正确的是
。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强( | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法正确的是( )
| n(N2) | n(H2) | n(NH)3 |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
t/min | 0 | 10 | 20 | 30 | 40 | 70 | 90 |
c/(mol·L-1) | 0 | 0.04 | 0.07 | 0.09 | 0.10 | 0.12 | 0.12 |
关于该反应,下列说法正确的是( )
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间/min | 达平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热 0.1a kJ |
② | 恒压 | 1 | 3 | 0 | t | 放热b kJ |
下列叙述正确的是( )
| 容器1 | 容器2 | 容器3 | |
| 反应温度/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是( )
|
容器编号 |
容器类型 |
初始体积 |
起始物质的量/mol |
平衡时SO3物质的量/mol |
||
|
SO2 |
O2 |
SO3 |
||||
|
I |
恒温恒容 |
1.0 L |
2 |
1 |
0 |
1.6 |
|
II |
绝热恒容 |
1.0 L |
2 |
1 |
0 |
a |
|
III |
恒温恒压 |
0.5 L |
0 |
0 |
1 |
b |

②曲线中平衡时的温度与起始时的温度相同。
则下列说法中错误的是( )
①
②
反应③的
, 平衡常数
(用
表示)。
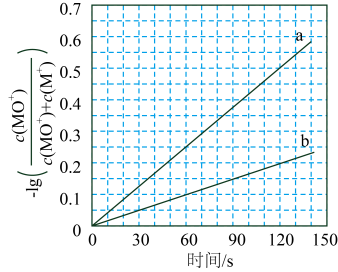

(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与
反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与
反应,氘代甲醇的产量
(填“>”“<”或“=”)。若
与
反应,生成的氘代甲醇有种。
A.低温低压B.低温高压C.高温低压D.高温高压

①下列说法正确的是。
A.可循环利用,
不可循环利用
B.过程ⅱ,吸收
可促使
氧化
的平衡正移
C.过程ⅱ产生的最终未被
吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原需吸收的能量更多
②过程ⅱ平衡后通入 , 测得一段时间内
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升的原因。
①常压下和
按物质的量之比
投料,某一时段内
和
的转化率随温度变化如图1,请在图2中画出
间R的变化趋势,并标明
时R值。

②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
|
温度/℃ |
480 |
500 |
520 |
550 |
|
|
7.9 |
11.5 |
20.2 |
34.8 |
|
R |
2.6 |
2.4 |
2.1 |
1.8 |
下列说法错误的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中占比越高
C.温度升高,转化率增加,
转化率降低,R值减小
D.改变催化剂提高转化率,R值不一定增大
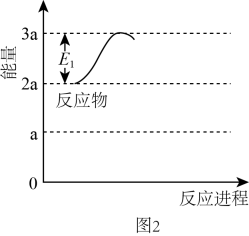
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。

决定该过程的总反应速率的基元反应方程式为。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2= kJ·mol-1

a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d. 比值不再发生变化

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是 (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=(MPa)-2(用最简分数表示)。
Ⅰ.
Ⅱ.
回答下列问题:
①当转化率达到60%时,反应达到平衡状态,这时
和
的平均相对分子质量为23,若反应Ⅱ的
, 平衡时反应速率
;
②经验公式为
, 其中
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
(用含
、
、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是。

由图可知,温度相同时选择性的实验值略高于其平衡值,可能的原因是。
a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:

已知时,
, 平衡体系总压强为P,则
反应c的平衡常数
。
2NH3(g) + H2O(1) + SO2(g)=(NH4)2SO3(aq) ΔH=akJ/mol
2NH4HSO3(aq)=((NH4)2SO3 (aq) + H2O(l) + SO2(g) ΔH =bkJ/mol
2(NH4)2SO3(aq) + O2(g)= 2(NH4)2SO4 (aq) ΔH = ckJ/mol
反应2NH3(g) + 2NH4HSO3(aq)+O2(g)= 2(NH4)2SO4+(aq)的 ΔH = kJ/mol(用含a、 b、c的代数式表示)。
①上述条件下H2S的平衡转化事α1= %。
②若在620 K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH 0(填“<” “>”“<或=”)。
③在610 K时反应H2S(g) + CO2(g) COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是 (填标号)。
A.向容器中通入H2S B.向容器中通入CO2
C.加入催化剂 D.缩小容器的体积

①压强: p2 p1(填:“>”或”<”) :判断的理由是。
②若p1=8.1MPa,起始时充入a mol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp= MPa(用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
已知:
Ⅰ.N2(g)+3H2(g)⇌2NH3(g) ΔH1= -92 kJ·mol-1
Ⅱ. C(s)+O2(g)⇌CO2(g) ΔH2= - 394 kJ·mol-1
Ⅲ. N2(g)+ 3H2(g)+C(s)+O2(g)⇌H2NCOONH4(s) ΔH3= - 646 kJ·mol-1
Ⅳ.H2NCOONH4(s)⇌2NH3(g)+ CO2(g) ΔH4
回答下列问题:
A.当N2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变

某学习小组的同学通过讨论得出结论: 200℃时, a点对应的转化率(5%)不是使用催化剂甲下H2的平衡转化率。判断依据是:。
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
Ⅱ.2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH=+210.5kJ·mol-1
CO2加氢合成乙烯的热化学方程式为。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—48.5kJ·mol-1
Ⅱ.2CO2(g)+5H2(g) C2H2(g)+4H2O(g) ΔH=+37.1kJ·mol-1
在压强为P,CO2、H2的起始投料为1:3的条件下,发生反应I、Ⅱ,实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度的变化如图所示:

已知:CH3OH的选择性=
①有利于提高CH3OH的选择性的措施有(填序号)。
A.适当降温 B.适当升温 C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以(填“I”或“Ⅱ”)为主,并说明理由。
③其中表示平衡时CH3OH的选择性的曲线是填“a”或“b”)。
④400℃时,在该压强及投料比的条件下,利用图示所给数据计算H2的转化率为(保留三位有效数字)。

①
H
②
H1=+40.9kJ/mol
③
H2=-90.4kJ/mol
试计算HkJ/mol。

①投料比n(CO2):n(H2)=l:3的曲线是。(填“a”、“b”或“c”)
②已知点N在曲线b上,计算该温度下压强平衡常数Kp=(MPa)-2.(用平衡分压代替平衡浓度计算)
③该温度下,测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=。(保留2位有效数字)

①该反应的活化能Ea=kJ/mol。
②当用更高效催化剂时,请在图中画出Rlnk与关系的曲线。

①温度为T1时,该反应的正反应速率v(B)正v(A)逆(填“>”,“=”或“<”)。
②B、C、D三点逆反应速率由大到小的顺序为。[用“v(D)”、“v(C)”、“v(B)”表示]
I.和
在一定条件下合成甲醇:



容积 | |||
甲容器 | VL | 1mol | amol |
乙容器 | VL | 2mol | 2amol |
①请在图中画出乙容器中的平衡转化率曲线乙。
②当乙容器中的平衡转化率与甲容器M点相同时,该反应的平衡常数之比
。
实验发现,其他条件不变时向上述体系中投入一定量的CaO,反应相同时间测得的体积分数增大,其可能的原因是。
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数

H2S+ NOx= S+ + N2
吸收CO2的主要化学反应:
2NH3(aq)+CO2(g)+H2O(l)(NH4)2CO3(aq)+99.3kJ
NH3(aq)+CO2(g)+H2O(l)NH4HCO3(aq)+26.4kJ
2NH3(aq)+CO2(g)NH2COONH4(aq)+135.9kJ
2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)
该反应的化学平衡常数表达式K=。
a.2v(CO2)正=3v(H2O)逆
b.容器中总压强不变
c.容器中混合气体的密度不变
d.容器中CO2的体积分数不变

写出氨基甲酸铵水解的离子方程式。

①25℃时,和
的燃烧热
分别为akJ/mol和bkJ/mol,上述合成氨反应的焓变为kJ/mol。
②A点的温度迅速从变为
, 则此时浓度商QK(
)(填“>”“<”或“=”)。
③(
为以分压表示的平衡常数,分压=总压×物质的量分数)。
④合成氨逆反应速率方程为: , 式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为。

①导线中电子流动方向为。
②生成的电极反应式为。
③若惰性电极2的电流效率η为75%,则惰性电极2处与
的物质的量之比为。(
)