
选项 | 操作 | 现象 | 结论 |
A | 向菠菜汁中加入少量稀硝酸,再滴入几滴KSCN溶液 | 溶液变红 | 菠菜汁中含有Fe3+ |
B | 将在酒精灯上灼烧后的铜丝迅速插入乙醇中 | 铜丝表面由黑色变为红色 | 乙醇具有还原性 |
C | 相同温度下,用pH计分别测定0.010 mol/LHF溶液和0.010 mol/L CH3COOH溶液的pH | HF溶液pH更小 | Ka(HF)<Ka(CH3COOH) |
D | 向0.01 mol/L FeCl3溶液中,加入少量FeCl3固体 | 溶液颜色加深 | Fe3+水解程度增大 |
电离平衡常数 | Ka1 | Ka2 |
H2CO3 | 4.5×10-7 | 4.7×10-11 |
CH3COOH | 1.75×10-5 | —— |


已知氯气溶解存在以下过程:
①Cl2(aq) + H2O(1) H+(aq) + Cl-(aq) + HClO(aq) K1= 4.2×10-4
②Cl2(aq) + Cl-(aq) (aq) K2= 0.19
③HClO(aq) H+(aq) + ClO-(aq) Ka= 3.2×10-8
下列说法错误的是


已知:Ka1(H2T)=10-3.04 , Ka2(H2T)=10-4.37。
下列说法正确的是



已知常温下 ,
;
,
。
①钠离子电池工作时, 转化为
,则
在电池(填“正”或“负”)极放电。
② 在制
的反应中的作用:。
③ 溶液中含P元素离子的浓度由大到小的顺序为。

①该晶胞中, 和K的原子数之比为。
②该晶体的密度为 (设阿伏加德罗常数的值为
,用含a、
的代数式表示)。

已知:①溶液捕获CO时生成Pd单质;
②能溶于有机溶剂,遇水会水解生成难溶于水的物质;
难溶于水。
回答下列问题:
![]()
已知:难溶于冷水,在热水中易水解;
的水解是由水解、电离、水解三步进行(如下):
①水解:
②电离:
③水解:
其中①为快反应,对②、③反应的影响是,加入硫酸铵的目的是。
a. b.
c.

①
②
③
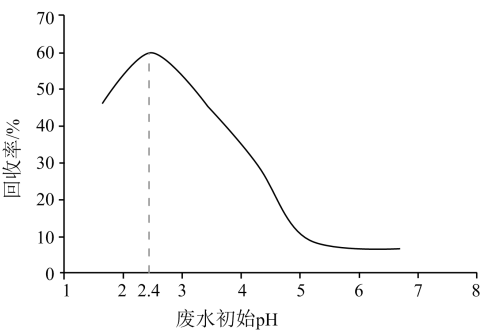
为了增大产物中的占比,可以采用的措施是(答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为:
, 放电时正极的电极反应式为。
化学式 | CH3COOH | HClO | H2CO3 |
电离常数(Ka) | 1.8×10−5 | 3×10−8 | K1=4.4×10−7 K2=4.7×10−11 |
请回答下列问题:
①写出盐酸肼第一步水解反应的离子方程式。
②写出盐酸肼水溶液中离子浓度的大小关系是。
下列说法正确的是(填字母序号)。
a.0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)=c()+2c(
)+c(OH-)
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c()>c(
)>c(H2C2O4)
c.浓度均为0.1mol•L-1KHC2O4和K2C2O4的混合溶液中:3c(K+)=2c()+2c(
)+2c(H2C2O4)
d.0.1mol•L-1KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)

已知:i.pH>4时,Fe2+易被氧气氧化
ii.几种物质的溶解度(g/100gH2O)如表:
FeSO4•7H2O | (NH4)2SO4 | FeSO4• (NH4)2SO4•6H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
①用稀硫酸调溶液pH至1~2的目的是:,。
②趁热过滤的原因是:。
③为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关K1和K2 , 设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。(FeC2O4的摩尔质量为144g/mol)

实验操作为:打开K1 , K2 , 缓缓通入氮气;点燃酒精灯,小火加热;熄灭酒精灯,冷却至室温,停止通入氮气,关闭K1 , K2;称重A。重复上述操作步骤,直至A恒重,记为m3g。假设此过程中FeC2O4不分解,根据实验记录,计算草酸亚铁晶体中结晶水数目x=(列式表示)。
弱酸 | CH3COOH | H2CO3 | HClO |
电离常数 |
根据表中数据,将pH=3的下列三种酸溶液分别稀释100倍,pH变化最小的是(填标号)。
a.CH3COOH b.H2CO3 c.HClO

已知: ,
;x、z两点的坐标为x(7.3,1.3)、z(12.6,1.3)。
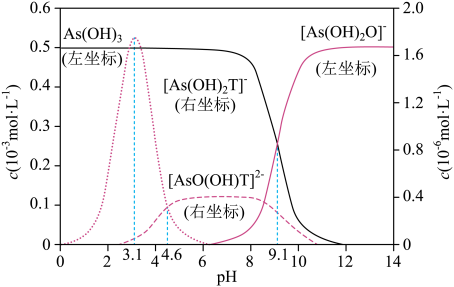
H3PO3与足量的NaOH溶液反应的离子方程式为。
|
氧化物 |
MgO |
| |
| 熔点/℃ | 2800 | 23.8 | -75.5 |

①由此可知溶液呈(填“酸性”或“碱性”)
②写出在水中存在的两个平衡:ⅰⅱ。
这两个平衡程度的大小关系是:ⅰⅱ。(填“<”或“>”)
其中甲同学设计图1装置(盐桥中为KCl),闭合开关后灵敏电流计指针发生偏转。

①通过验证新产物也可以帮助确认正、负两极,验证电源正极生成物的实验操作方法是。
②闭合开关后盐桥中的移向(填“左”或“右”)侧的烧杯。
③负极的电极反应。
④乙同学按图2操作,并没有出现预期的现象,而是溶液很快呈红色。大约30mm后红色变为橙色,5小时后变为黄绿色。
因此,乙认为刚开始一段时间并不涉及氧化还原反应。
查阅资料:溶液中、
、
三种微粒会形成一种组成为
的“配合物”并存在转化关系:
请从反应速率和平衡的角度解释原因。
提出假设:稀释溶液或改变
浓度,
电离平衡会发生移动。设计方案并完成以下实验用浓度均为
的
和
溶液,按下表配制总体积相同的系列溶液;测定
, 记录数据。
序号 | |||||
I | 40.00 | / | / | 0 | 2.86 |
II | 4.00 | / | 36.00 | 0 | 3.36 |
… | |||||
VII | 4.00 | a | b | 4.53 | |
VIII | 4.00 | 4.00 | 32.00 | 4.65 |
①根据表中信息,补充数据:a=,b=。
②由实验I和II可知,稀释溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据,给出判断理由:。
①移取溶液于锥形瓶中,加入2滴溶液R,用
溶液滴定至终点,消耗体积为
, 则R是(填名称),该
溶液的浓度为
。
I | 移取 |
II | (填实验操作步骤),测得溶液的 |
实验总结得到的结果与资料数据相符,方案可行。
ⅰ.取a mL稀溶液于锥形瓶中,加入2滴酚酞溶液。
ⅱ.用标准溶液滴定至终点,消耗NaOH溶液的体积为
。
ⅲ.另取一份该稀溶液于烧杯中,用pH计测得其pH为x。
ⅱ中滴定恰好达到终点时的现象为。
醋酸的电离平衡常数。代入相关数据,即可得。
误差分析:若ⅰ中锥形瓶提前用该稀溶液进行了润洗,会使测得的
(填“偏大”或“偏小”)。
由的电离平衡常数表达式可知,当
时,
。
实验步骤:①取25mL某溶液,用NaOH溶液滴定至终点。
②继续向①中加入25mL该溶液。
③用pH计测定②中混合溶液的pH为y。
步骤②的目的是。
已知亚磷酸(H3PO3)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是____(填字母序号)。
|
酸 |
|
CH3COOH |
|
HCl |
|
电离平衡常数 |
|
|
|
—— |
回答下列问题。
①溶液中的(填“增大”“减小”“不变”或“无法判断”)。
②当滴加溶液至溶液中的
, 此时溶液中的pH7(填“<”“=”或“>”),判断的依据。
①达到滴定终点的现象是。
②在滴定实验过程中,下列仪器中有蒸馏水,对实验结果没有影响的是(填“滴定管”或“锥形瓶”)。
③经3次平行实验,达到滴定终点时,消耗标准溶液体积的平均值为19.98
, 则此
溶液的浓度是。