 违反了泡利不相容原理
D .
违反了泡利不相容原理
D . 周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。


已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标
 D . 次氯酸的电子式:
D . 次氯酸的电子式: C . 基态Cr的电子排布式:
C . 基态Cr的电子排布式: B . O3分子的球棍模型:
B . O3分子的球棍模型: D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3


针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
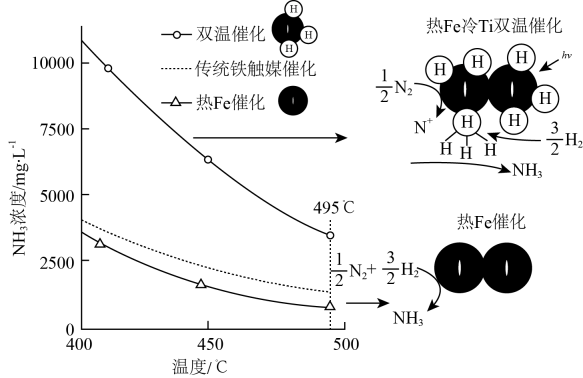
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

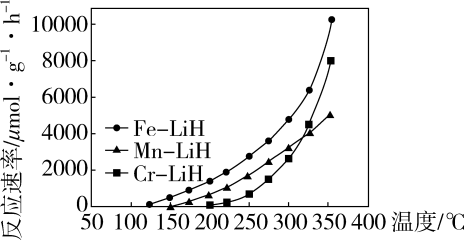
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
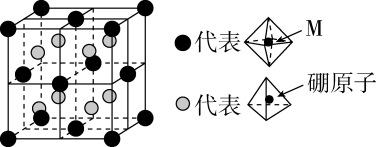
含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
A. B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。

①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
,
),则B原子的坐标为。

①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为。
②色胺酮分子中N原子的杂化类型为。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过作用与色胺酮钴配合物相结合。

①距离Mg原子最近的Ni原子有个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA , 该晶体的密度为g•cm-3。(1nm=10-9m)
①Fe2+的价层电子排布式是。
②乳酸分子(![]() )中 σ 键与π键的数目比为。
)中 σ 键与π键的数目比为。
③乳酸亚铁中各元素的电负性由大到小的顺序为。
④C与O中,第一电离能较大的是, O的第二电离能远大于第一电离能的原因是。
①[Fe(NH3)6]Cl2中Fe2+的配位数为。
②NH3的空间构型是,其中N原子的杂化方式是。

①该超导材料的化学式是。
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=g·cm-3。(用 NA表示阿伏加德罗常数,写出计算表达式即可)
③该晶胞在xy平面投影如图2所示,将图2补充完整。

 )中同周期三种元素电负性由大到小的顺序为,氮原子的杂化方式为,C=N与C-C键夹角C=N与N-O键夹角(填“<”“>”或“=”)。
)中同周期三种元素电负性由大到小的顺序为,氮原子的杂化方式为,C=N与C-C键夹角C=N与N-O键夹角(填“<”“>”或“=”)。

一个T-碳晶胞中含有个碳原子。 T-碳的密度非常小,是金刚石的一半,则T-碳晶胞的棱长和金刚石晶胞的棱长之比为。

a.属于分子晶体
b.沸点高于对羟基苯甲酸
c.相同条件下,在水中的溶解度小于对羟基苯甲酸
①基态的价电子排布式为。
②实验发现对羟基苯甲酸不能与氯化铁发生显色反应,试从化学平衡的角度解释其原因是。
 ,然而实际生产中该反应产率极低。已知:
,然而实际生产中该反应产率极低。已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理:
ii.苯酚中O原子2p轨道与C原子2p轨道平行,O原子p轨道电子云与苯环大π键电子云发生重叠,电子向苯环转移,降低了氧原子周围的电子云密度。
①比较O、C电负性大小,并从原子结构角度解释两元素电负性差异的原因是。
②请结合已知信息,分析以邻羟基苯甲酸和乙酸为原料制备阿司匹林产率偏低的原因是。
A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6 , 其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于分子(填“极性”或“非极性”),分子中Al采取杂化。


①六方相氮化硼结构与石墨相似,但是却不导电的原因是。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm=m3·mol-1 (列出计算式)。
a.![]() b.
b.![]() c.
c.![]()
的结构如图1所示。

①和
之间的作用力类型为。
②的
大于
的
, 从结构角度解释原因:。

①由于的空间构型为,且磷氧键键能较大,锂离子嵌入和脱出时,磷酸铁锂的空间骨架不易发生形变,具有良好的循环稳定性。
②正极材料在和
之间转化时,经过中间产物
。
转化为
的过程中,每摩晶胞转移电子的物质的量为摩。

①基态26Fe2+的价层电子排布式为。
②草酸亚铁晶体中Fe2+的配位数为。
③草酸亚铁晶体的化学式为。
①从结构的角度分析,氮气能用作保护气的原因是。
②反应体系在100~400℃之间具有较大的失重,导致失重的原因之一是NH4H2PO4分解,补全方程式。。
NH4H2PO4
+
+
P2O5

①i表示(填“充电”或“放电”)过程。
②已知:Li+的脱嵌率=×100%。某时刻,若正极材料中n(Fe2+):n(Fe3+)=3:1,则Li+的脱嵌率为,平均每个晶胞脱嵌个Li+。

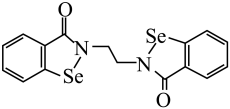
①基态Se原子的核外电子排布式为[Ar]。
②该新药分子中有种不同化学环境的H原子。
③SeO的空间构型为。

①基态Fe2+的价电子轨道表示式为。
②富马酸分子中σ键与π键的数目比为。
③富马酸亚铁中各元素的电负性由大到小的顺序为。

A.配位键 B.离子键 C.共价键 D.氢键
 )在水中的溶解度远大于在苯中的溶解度,可能原因是
)在水中的溶解度远大于在苯中的溶解度,可能原因是①吡啶和H2O均为极性分子,而苯为非极性分子;
②。
吡啶及其衍生物(![]() 、
、 )的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
)的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。



①基态As原子的核外电子排布式为[Ar]。
②雌黄中As—S—As键角(填“大于”“小于”或“等于”)S—As—S键角。
③雄黄和雌黄比砷的氧化物的毒性要小很多,除结构稳定性的原因之外,从物理性质的角度分析,还与其有关。
①青金石的结构中、S2-代替了方钠石中部分Cl—的占位,Ca2+代替了部分Na+的占位,则方钠石的化学式为。
②青金石中第三周期各元素的第一电离能由大到小的顺序为。
③青金石的颜色与骨架内填入的阴离子有关,其中一种重要阴离子是三硫自由基阴离子。研究表明,三硫自由基阴离子(II)可以通过多硫阴离子S(I)在高温下的均裂反应得到,并最终可能异构化为另一种S
的异构体(III),过程如下图:

关于I、II、III三种物质,下列说法正确的有(填字母)。
A.I中的S—S键都是σ键
B.II中的S原子最外层都满足8电子稳定结构
C.II的中心硫原子的杂化轨道类型为sp
D.与II互为等电子体
E.III一定为平面形结构

①该方解石结构中阴离子的空间构型为。
②设NA为阿伏加德罗常数的值,则该方解石晶体的摩尔体积Vm=m3•mol-1(列出算式)。