 )是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是
)是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是
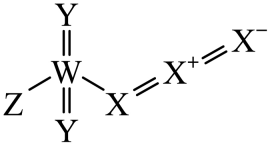



我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
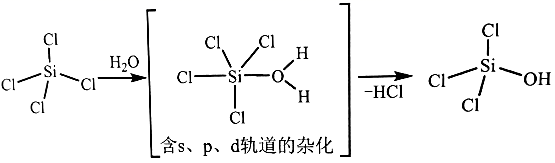 含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。

①氮与镓之间形成的化学键类型为,镓原子的配位数为。
②传统制备氮化镓是采用与
在一定条件下反应制备,不采用金属
与
制备的原因是。


①比较硫化氢与氨气键角的大小:H2SNH3(填“>”或“<”) 。
②第二周期元素中,第一电离能大于N的元素有(用元素符号表示)。
③请解释该化合物易溶于水的主要原因:。
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有个。


①In的配位数为;晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为。
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为g·cm-3(列出计算式)。

Cu+填充了晶胞中四面体空隙的百分率是,S2-配位数为。若晶胞参数a nm,晶体的密度为dg·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是,为了能观察到溶液Ⅰ中[Cu(H2O)4]2+呈蓝色,可采取的方法是。
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1 , Cl-的转化率为(用a、b、c中的字母表示)。
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=mol•L-1 (已知:Cu(OH)2的Ksp=2.2×10-20)
④向溶液Ⅱ中通入NH3至过量观察到的现象是。

 )水溶性优于2﹣巯基烟酸氧钒配合物 (
)水溶性优于2﹣巯基烟酸氧钒配合物 ( )的原因是。
)的原因是。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为 (0,0,0),D为 ( ,
, 0),则E原子的坐标参数为。X﹣射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为pm (只列计算式)。
②已知六方氮化硼同层中B﹣N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表这式为pm (已知正六边形面积为 , a为边长)。
③同一周期中,第一电离能介于B、N之间的元素有种。
 )。
)。①AlCl的空间构型为;Al2Cl
中各原子最外层均达到8电子结构,则其结构式为。
②1molEMIM+中所含σ键为mol,EMIM+中环上所有原子共面,其中氨原子的杂化方式;为分子中的大π键可用Π符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
),则EMIM+中的大π键应表示为。
③为使EMIM+以单个形式存在以获得良好的溶解性能,与N原子相连的-CH3、-C2H5 , 不能被H原子替换,其原因是。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,
,
),则C点Al原子在z轴方向上的分数坐标z=(用含c、s的代数式表示);已知:阿伏加德罗常数的值为NA , 则该晶体的密度为g•cm-3(列出计算表达式)。

若图中原子1的坐标为 ,则原子2的坐标为。

①该物质中含有的化学键类型有(填标号)。
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是。
 , 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。
, 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。

a.离子键 b.共价键 c.配位键 d.氢键


 回答下列问题:
回答下列问题: