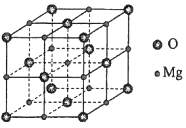
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示, 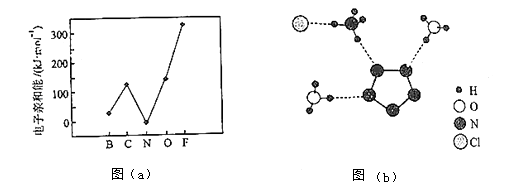
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是.
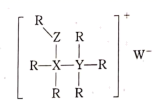
①从结构角度分析,R中两种阳离子的相同之处为,不同之处为.(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为.
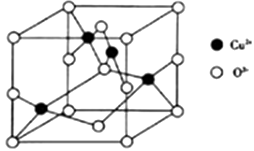
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、.
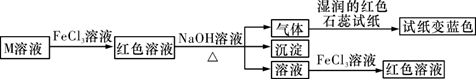
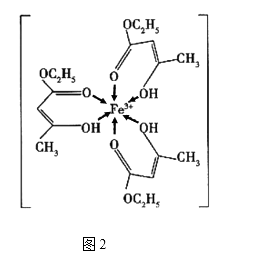
①制元素在周期表中的位置是,[Cu(NH3)4]SO4中,N、O、S 三种元素的第一电离能由大到小的顺序为。
②[Cu(NH3)4]SO4中,存在的化学键的类型有 (填字母)。
A离子键 B金属键
C.配位键
D.非极性键 E极性键
③ NH3中N原子的杂化轨道类型是,写出一种与SO42-互为等电子体的分子的化学式:_ 。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为。
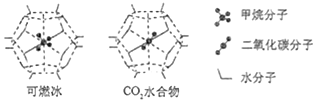
①“可燃冰”中分子间存在的2种作用力是;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想的依据是:。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
回答下列问题
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键 g.σ键 h.π键
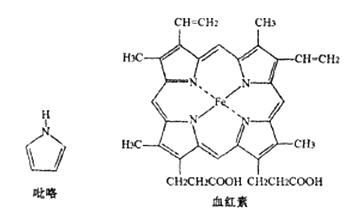
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1mol吡咯分子中所含的σ键总数为个。分子中的大π键可用中表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
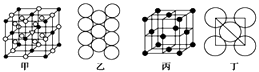
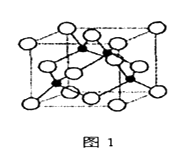
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为个; Al晶体的密度为(用字母表示)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
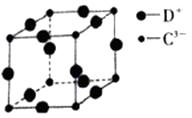
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
①根据上述数据分析,B在周期表中位于区,其最高价应为;
②若某同学将B原子的基态外围电子排布式写成了ns1np1 , 违反了原理;
③B元素的第一电离能大于Al,原因是;
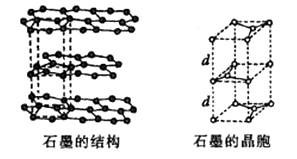
①已知金刚石中的C﹣C的键长为154.45pm,C60中C﹣C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由.
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为.
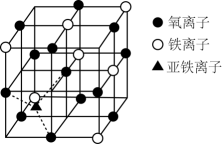
①晶胞中二价铁离子处于氧离子围成的(填空间结构)空隙。
②若晶胞的体对角线长为a , 则
晶体的密度为
(阿伏加德罗常数用
表示)。