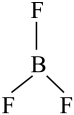
 (平面三角形)
D .
(平面三角形)
D .  (平面三角形)
D . 基态铜原子的价层电子排布图:
(平面三角形)
D . 基态铜原子的价层电子排布图: C . H2O中O原子的杂化轨道类型为
C . H2O中O原子的杂化轨道类型为

这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。


①中N原子的杂化类型是;NH3分子的立体构型是。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有个未成对电子。1 mol该阳离子含有的σ键数目为
③NH3能与Cu2+形成[Cu(NH3)4]2+ , 而NF3不能,其原因是,NH3的沸点比NF3 ( 选填“高”或“低”),原因是。

已知:晶胞参数为a nm。
①合金中粒子间作用力类型是。
②与Cu原子等距离且最近的Cu原子有个。
③黄铜合金晶体密度为g·cm-3。(设NA为阿伏加德罗常数的值)

①B处原子的原子分数坐标为。
②已知灰锡的密度为ρg·m-3 , 设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=pm(可只列式不计算)。
①TiCl4分子的空间构型为。
②N-甲基咪唑分子中碳原子的杂化轨道类型为,C、N、Si的电负性由大到小的顺序为,1个![]() 含有个π键。
含有个π键。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是(填“Mg2+”或“Cu2+”)。

氯乙酸(ClCH2COOH)是重要的有机化工原料,实验室中先用KMnO4 , 和浓盐酸制备干燥、纯净的Cl2 , 然后将Cl2通入冰醋酸中生成氯乙酸。回答下列问题:

①下列立方堆积模型中符合钾、锰堆积方式的为(填标号)。
A、 
B、 
C、 
②NA为阿伏加德罗常数的值。锰的摩尔质量为Mg·mol-1 , 晶胞的密度为d g·cm-3 , 则锰的晶胞参数为nm(用含Nλ、M、d的式子表示)。
基态铁原子的价电子排布式为, 中,除氢元素外,其余三种元素第一电离能最大的是(填元素符号)。
白磷在氯气中燃烧可以得到 和
,其中气态
分子的立体构型为。

①锑酸亚铁的化学式为。
②晶体的密度为 (设
为阿伏加德罗常数的值)。

A.[Ne]3s13p2 B.[Ne]3s23p1

①该晶胞内存在共价键数目为;
②紧邻的N原子之间距离为b,紧邻Al、N原子间距离为d,则b:d=;
③该晶体的密度为g·cm-3(阿伏加德罗常数的值用NA表示)。
 。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。
。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。

①该化合物的化学式是。
②已知晶胞参数为5.93A,Si与Al之间的共价键长是(写出计算表达式)。
|
卤化物 |
CrCl3 |
CrBr3 |
CrI3 |
|
熔点/℃ |
1150 |
600 |
试预测CrBr3的熔点范围。
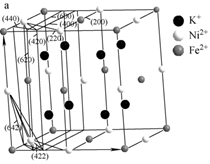

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
,
)。则D原子的坐标参数为,它代表原子。
②若Cu2O晶体密度为dg·cm-3 , 晶胞参数为apm,则阿伏加德罗常数值NA=。

①基态钴原子的核外电子排布式为[Ar]。
②甲醛分子中三种元素电负性由大到小的顺序为(填元素符号);甲醛分子的立体构型为;分子中σ键与π键数目比为。


②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是。
| 化合物 | BF3 | BCl3 | BBr3 | BI3 |
| 熔点/℃ | -126.8 | -107.3 | -46 | 44.9 |



 B .
B .  C .
C .  D .
D . 

①Sb位于晶胞的顶点和体心,则图中A代表的原子是。
②原子A的坐标为 ,原子B的坐标为
,则原子C的坐标为。
③设阿伏加德罗常数的值为 ,则
的密度为
(列出计算表达式)。
①配合物中非金属元素的电负性最大的是;
②1,2,4-三氮唑分子中碳原子的杂化方式是。含σ键数为个;
③ 的空间构型为。

六棱柱底边长为apm,高为cpm,晶体的密度为ρg·cm-3.铁原子半径为,阿伏加德罗常数的值NA为。(列出计算式即可,sin60°= )
 熔点较低,其原因是。
熔点较低,其原因是。


已知TiO2晶胞为长方体,设阿伏加德罗常数的值为NA , TiO2的密度为g/cm3(列出计算式)。TiO2-aNb晶体中a=,b=。

①硼酸为晶体;晶体中各层之间的作用力为。
②四硼酸根中硼原子的杂化方式为。
①NH 与CO
的空间构型:NH
:CO
。
②MgO晶体结构属于NaCl型(如图),图中表示Mg2+的为(填“大球”或“小球”),其配位数是;MgO晶胞参数为a pm,则MgO晶胞的密度为g·cm-3(NA表示阿伏加德罗常数的值,用含a、NA的式子表示)。
