|
选项 |
性质差异 |
结构因素 |
|
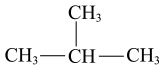
A |
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃) |
分子间作用力 |
|
B |
熔点: |
晶体类型 |
|
C |
酸性: |
羟基极性 |
|
D |
溶解度(20℃): |
阴离子电荷 |
已知 | 方法 | 结论 | |
A | 沸点: | 类比 | 沸点: |
B | 酸性: | 类比 | 酸性: |
C | 金属性: | 推理 | 氧化性: |
D |
| 推理 | 溶解度: |
 B .
B .  B .
B . 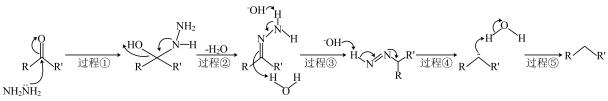
 +OH—
+OH— +N2↑+H2O
D . 应用该机理,
+N2↑+H2O
D . 应用该机理, 可以在碱性条件下转变为
可以在碱性条件下转变为

| 物质 | 熔点/℃ |
| | 800.7 |
| | |
| | |
| | |
与
均为第三周期元素,
熔点明显高于
, 原因是。分析同族元素的氯化物
、
、
熔点变化趋势及其原因。
的空间结构为,其中
的轨道杂化形式为。



酞菁分子中所有原子共平面,其中轨道能提供一对电子的
原子是(填图2酞菁中
原子的标号)。钴酞菁分子中,钴离子的化合价为,氮原子提供孤对电子与钴离子形成键。



物质 | 肼 | 偏二甲肼 |
熔点 | 1.4℃ | -58℃ |
沸点 | 113.5℃ | 63.9℃ |
二者熔沸点差异较大的主要原因是。

NaCl | MgCl2 | AlCl3 | |
熔点/℃ | 801 | 714 | 194 |
NaCl、MgCl2熔点比AlCl3熔点高的原因是。
物质 | ||||
熔点/℃ | 827 | 275 | 394 | 446 |
与
熔点相差较大,
、
、
熔点依次增大,原因是。
物质 | 电离平衡常数 |
| |
|
从结构角度分析顺丁烯二酸的小于反丁烯二酸的
的原因是。
氧化物 | ||||
熔点/℃ | 1570 | 1132 | 23.8 | -75.5 |
解释表中氧化物之间熔点差异的原因。
|
物质 |
|
|
|
|
熔点 |
280℃ |
3550℃ |
3652℃ |
和金刚石熔点相差大,石墨的熔点比金刚石高,原因是。
化学式 | P4S3 | C3N4 |
用途 | 制造火柴及火柴盒摩擦面 | 可用作切磨机、钻头、轴承 |
熔点 | 174℃ | 1900℃ |
请从结构和微观作用力的角度解释两种物质的熔点差异。


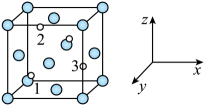
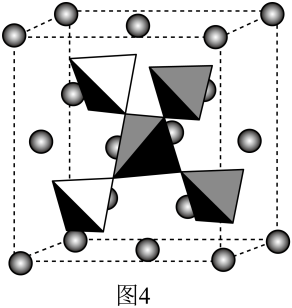
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图中原子1的坐标为( ,
,
),则原子2的坐标为。晶体中距离Fe最近的S有个。
②设阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。

回答下列问题:

a.金属Ni导电 b.燃烧放热 c.日光灯通电发光 d.乙醇挥发
配合物 | 状态 | 溶解性 |
无色挥发性液体 | 不溶于水,易溶于苯、四氯化碳等有机溶剂 | |
红黄色单斜晶体 | 易溶于水 |
熔点高于
的原因是;
为分子(填“极性”或“非极性”),Ni提供的空轨道数目为。

a.  b.
b. 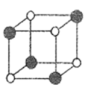 c.
c.  d.
d.  e.
e. 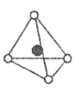
已知该晶体密度为 , NA为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为pm(用含ρ和NA的代数式表示)。
镓的卤化物 | |||
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
①100℃,、
和
呈液态的是(填化学式)。
②的熔点约1000℃,远高于
的熔点,原因是。
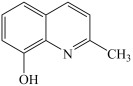 )在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。
)在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。
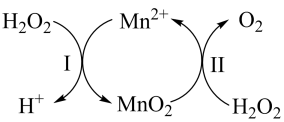
已知反应Ⅱ为:
, 写出反应Ⅰ的热化学方程式(焓变用
和
表示):。
物质 | 金刚石 | 石墨 |
熔点 | 3550℃ | 3652℃ |
摩尔硬度 | 10 | 1 |
请从结构角度分析两者熔点相近但摩尔硬度有差异的原因。
TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点℃ | 377 | -24 | 38.3 | 153 |
它们熔点差异的原因

|
化合物 |
TiF4 |
TiCl4 |
TiBr4 |
TiI4 |
|
熔点/℃ |
377 |
-24.12 |
38.3 |
155 |
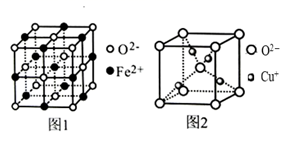
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为。
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数)
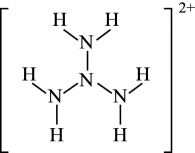
①氨水中存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D. 键 E.
键
② 中配体是,所含元素中电负性最小的非金属元素是(填元素符号)。
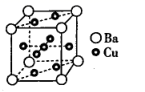

A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
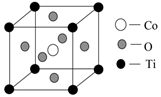
①晶胞中离Ti最近的O有个,其中Co原子位于O原子构成的空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3 , 则晶胞中Ti与O的最近距离是nm(用含ρ、NA的代数式表示,相对原子质量O-16,Co-59,Ti-48)。
|
名称(化学式) |
状态 |
熔点 |
溶解性 |
说明 |
|
四羰基镍 [Ni(CO)4] |
无色挥发性剧毒液体 |
-25℃ |
不溶于水,易溶于苯、四氯化碳等有机溶剂 |
正四面体分子、分子中碳原子与镍成健 |
|
氧化镍(NiO) |
绿色粉末状固体 |
1980℃ |
不溶于水 |
阴离子、阳离子构成 |
由此判断:[Ni(CO)4]是配合物,其配位体是。[Ni(CO)4]分子是分子(填“极性”或“非极性”)。[Ni(CO)4]比NiO熔点低的原因是。
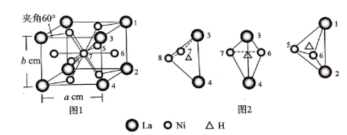
晶体中Ni、La的原子个数比=。每升该储氢材料达到储氢稳定状态,储氢原子mol。