
实验编号 | 温度 ℃ | Na2S2O3 | H2SO4 | 加入H2O 的体积/mL | 出现浑浊的时间/s | ||
体积mL | 浓度mol•L-1 | 体积mL | 浓度mol•L-1 | ||||
1 | 20 | 10 | 0.1 | 10 | 0.1 | 0 | 4 |
2 | 20 | 5 | 0.1 | 10 | 0.1 | V | 8 |
3 | 60 | 10 | 0.1 | 10 | 0.1 | 0 | 2 |
下列说法错误的是( )
| 实验目的 | 主要玻璃仪器 | 试剂 | |
| A | 配制100mL,pH=2的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管 | pH=1的盐酸、蒸馏水 |
| B | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、NaOH溶液 |
| C | 验证蔗糖水解产生还原性糖 | 试管、烧杯、酒精灯、玻璃棒、玻璃片、胶头滴管 | 蔗糖溶液、稀硫酸、10%NaOH溶液、2%CuSO4溶液、蒸馏水、pH试纸 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol/L盐酸 |


| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |
|
物质 |
H2(g) |
C(石墨,s) |
C6H6(l) |
|
燃烧热△H(kJ•mol-1) |
-285.8 |
-393.5 |
-3267.5 |
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1 , 当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于kPa。
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O
=CO2+CO
Ⅲ. Ⅳ.CO +2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为。
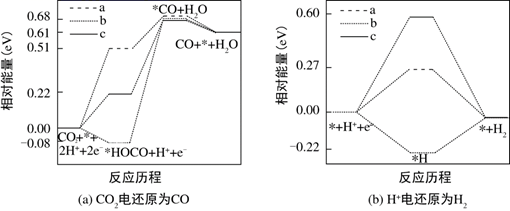
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为(用a、b、c字母排序)。
[实验Ⅰ]设计如表实验验证I2被氧化
装置 | 序号 | 试剂a | 现象 |
| 甲 | Na2SO3溶液 | 溶液均变黄,遇淀粉变蓝 |
乙 | KI溶液 |
①本实验中,试剂a作剂(填“氧化”或“还原”)。
②甲能证实I2被氧化而乙不能,原因是。
i.取vmLcmol·L-1KI溶液于锥形瓶中,通入过量Cl2至棕黄色褪去。
ii.边搅拌边加热锥形瓶中的溶液,一段时间后,操作A , 试纸不变蓝。
iii.冷却至室温后,加入过量KI固体,生成大量紫黑色沉淀(I2)。
iv.立即用amol·L-1Na2S2O3溶液滴定。滴定过程中沉淀逐渐溶解,溶液颜色逐渐变深再变浅。当溶液变为浅黄色时,加入淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液bmL。
已知:I2+2S2O=S4O
+2I-
I-+I2I
(棕黄色)
I2在纯水中溶解度很小,饱和碘水呈浅黄色
ii的目的是除去溶液中的Cl2 , 操作A是。
实验过程中,在未知x具体数值的情况下,iii中为保证所加的KI固体过量,理论上加入的n(KI)应大于i中n(KI)的(填数字)倍。
I.取100.0mL Na2CS3溶液置于仪器M中,打开K,通入一段时间氮气;
II.关闭K,打开分液漏斗活塞,滴入足量2.0mol·L-1稀H2SO4 , 关闭活塞;
III.反应结束后,再打开K,通入一段时间的热氮气;
IV.将B中混合物进行过滤、洗涤、干燥、称量,得到14.4g固体。

已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒,且CS2不溶于水,沸点46℃,与CO2某些性质相似。
回答下列问题:
 已知:“浸取”时PbO转化为Na2PbO2。
已知:“浸取”时PbO转化为Na2PbO2。
回答下列问题:
②结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是。
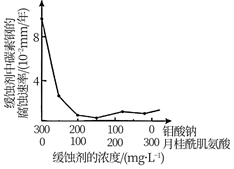
①若缓蚀剂钼酸钠-月桂酰肌氨酸的总浓度为300 mg/L,则缓蚀效果最好时钼酸钠( M=206 g/ mol)的物质的量浓度为mol/L(保留3位有效数字)。
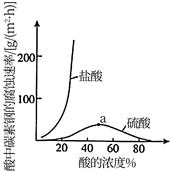
②a点前,随着酸的浓度增大,碳素钢在盐酸中的腐蚀速率明显比在硫酸中腐蚀速率快,其原因可能是,请设计实验证明上述结论。


已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

已知:浸出液的pH<2,其中的金属离子主要是Mn2+ , 还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。


I.问题探究
A.牛奶
B.Mg(OH)2
C.维生素C
D.小苏打
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100 mL 溶液。
②取25.00mL 溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B 为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/L KMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶 液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
实验①中氧化产物为N2 , 写出该反应的离子方程式:。
完成下列填空:
甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O,每1mol甲醛参加反应转移的电子数为个.甲醛中的碳的杂化方式为.(填sp、sp2、sp3)
HCOOH+Cu2O↓+2H2O,每1mol甲醛参加反应转移的电子数为个.甲醛中的碳的杂化方式为.(填sp、sp2、sp3)