①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:
。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用-甲醇标准溶液滴定至终点,消耗标准溶液
。根据上述实验原理,下列说法正确的是
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:
。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液
。对于上述实验,下列做法正确的是




下列叙述正确的是
 步骤①
B .
步骤①
B .  步骤②
C .
步骤②
C .  步骤③
D .
步骤③
D .  步骤⑤
步骤⑤







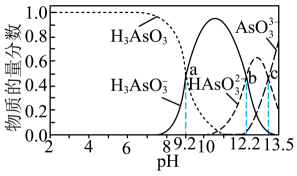
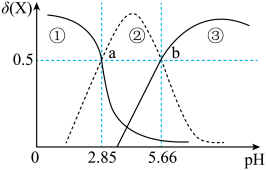
A.图中乙、丙线表示向溶液中滴加盐酸
B.根据图分析,d点可用甲基橙作指示剂指示滴定终点
C.溶液和
溶液中均满足
D.当滴加盐酸的体积为 mL时,a点所发生反应的离子方程式为
为了进一步研究消毒液的性质,兴趣小组向盛有2 mL 84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。猜测2:……
猜测1中反应的化学方程式为。猜测2可能为。

I、制备阶段
①氧化焙烧:在熔融碱中,用强氧化剂氯酸钾氧化Cr2O3 , 得到易溶于水的铬酸盐;
②熔块提取:用水浸取熔体,过滤,将滤液酸化;
③复分解结晶:向酸化后的滤液中加入细小KCl晶体,抽滤、干燥、得粗产品重铬酸钾。
II、纯度分析
称取1.000g的粗产品,配制成100mL溶液,取25.00mL用硫酸酸化,加入适量KI和指示剂,用Na2S2O3标准溶液滴定至亮绿色。
回答下列问题:


原理:
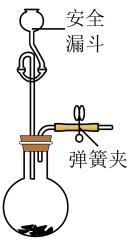
已知:气体有毒,遇水发生水解产生两种酸性气体
i.连接装置,检查装置气密性,装入药品并通;
ii.加热反应管至400℃;
iii.控制开关,加热 , 温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关、
的状态分别为。
②补全步骤v的操作:,其目的是。

已知:;
①绿色沉淀完全溶解后,继续加热一段时间再进行后续操作,目的是。
②样品中无水三氯化铬的质量分数为(结果保留三位有效数字)。
③若将碘量瓶换为锥形瓶,则样品中无水三氯化铬质量分数的测量结果(填“偏高”、“偏低”或“无影响”)。
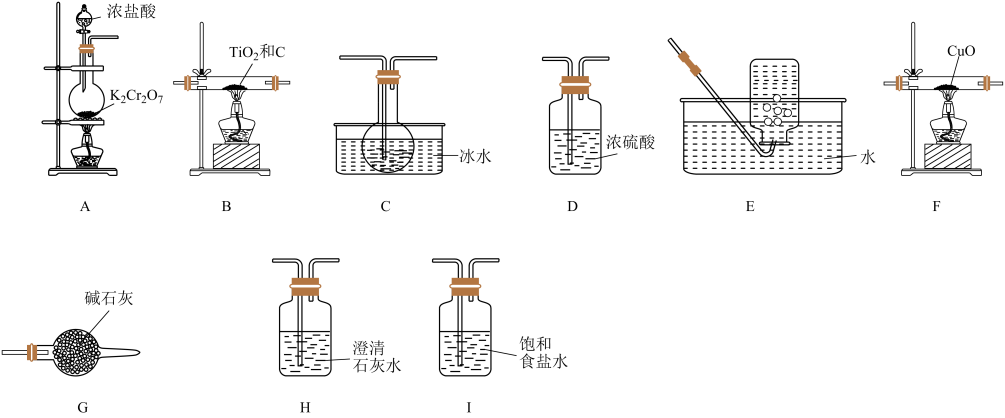
已知:遇潮湿空气会发生反应:
。
回答下列问题:
①安全漏斗中的水在本实验中的作用除加水外,还有;
②该沉淀滴定终点的判断方法是;
③该产品纯度为%。

请回答下列问题:
①滴定终点现象是。
②则NaC3N3O3Cl2的含量为。(用含m,c,V的代数式表示)

已知:遇水发生反应
;热稳定性差;能被
氧化为
;硫黄的熔点为113℃,沸点为445℃,
回答下列问题:
步骤1:检查装置气密性,加入硫黄,通氮气;
步骤2:一段时间后加热A中三颈烧瓶至110℃~115℃,使硫黄熔化;
步骤3:改通氯气,于115℃~125℃氯化一段时间后改通氮气;
步骤4:......;
步骤5:停止加热,持续通氮气至冷却。
①步骤1开始时需打开关闭(填“”、“
”或“
”)。通氮气的目的是;步骤4是。
②证明有生成的现象是。反应过程应控制
的量,原因是;装置C可选择(填标号)。

Ⅰ.实验前称重B装置为 , 实验后称重为
(均不包含冰盐水),取出
产品备用,剩余产品进行后续实验;
Ⅱ.撤掉装置A、C和B中冰盐水,重新更换足量的NaOH溶液,直接连接装置B、D;
Ⅲ.打开、
、
, 并不断向B中通入水蒸气、将
和
全部赶出;
Ⅳ.实验结束后,取下锥形瓶,滴加几滴酚酞,用盐酸标准溶液滴定剩余的
溶液,消耗盐酸
;
Ⅴ.不加样品,做空白对照实验,消耗盐酸。
①产品中的纯度为(写出表达式)。
②下列操作可能会导致测定结果偏高的是(填标号)。
a.水蒸气的通入时间较短
b.操作Ⅳ滴定后仰视滴定管读数
c.操作Ⅴ滴定前滴定管尖嘴处有气泡,滴定后无气泡
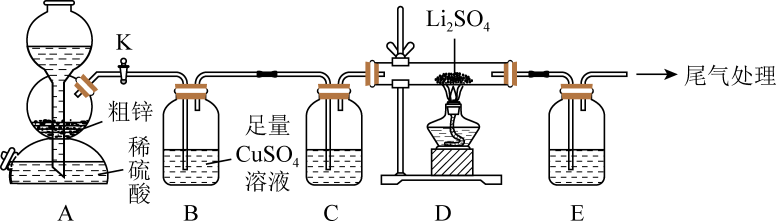
a.70%硫酸、亚硫酸钠 b.
:稀盐酸、大理石
c.:浓氨水、生石灰 d.
:浓盐酸、
①提出猜想:
猜想一:产品中含杂质
猜想二:产品中含杂质
猜想三:产品中含杂质S
依据所学知识,猜想三不成立,理由是。
②化学小组为验证猜想:
限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液
实验 | 操作与现象 | 结论 |
I | 取少量 | 样品中不含 |
II | 在实验I反应后的溶液中, | 样品中含 |
①煮沸的目的是。
②样品的纯度为。
①将20mLNaOH溶液加入仪器b中,冷水浴冷却,通入搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20gNaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
甲装置中a管的作用是。
①称取5.05g(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即)。
②离心分离除去水解得到的胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5min,过滤,得(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13g。
合成的离子方程式为。
a.NaOH溶液 b.饱和NaHS溶液 c.新制氯水
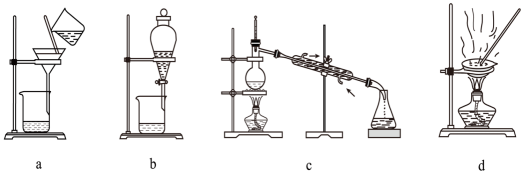
准确称取mg产品(杂质不含Zn元素)溶于足量盐酸,加热至不产生气泡,稀释成250mL溶液,准确量取25.00mL稀释后的溶液于锥形瓶中,调节pH在1.5~3,用二苯胺作指示剂,用的亚铁氰化钾{
}标准溶液滴定至终点,消耗标准溶液VmL。
已知:滴定反应为。
①加热的目的是。
②该产品中ZnS的质量分数为(用含m、c、V的代数式表示)%。
③如果其他操作均正确,滴定前俯视读数,滴定终点时仰视读数,那么测得结果(填“偏高”、“偏低”或“无影响”)。

已知:①水碎液中溶质主要成分为Na2SnO3、Na2TeO3、Na3AsO4和Na2PbO2;
②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
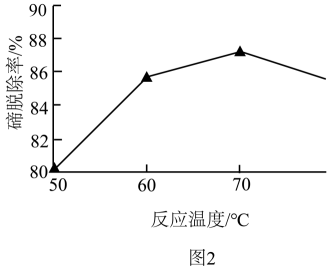
①取4.0 g碲产品,加入酸使其转化为亚碲酸(H2TeO3),将其配制成100 mL溶液,取20.00 mL于锥形瓶中。
②往锥形瓶中加入20.00 mL0.1 mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。
③用0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗12.00 mL硫酸亚铁铵标准溶液。
计算所得碲产品中碲的纯度为。