| A | B | C | D |
| | | | |
| 验证C的非金属性强于Si | 比较Fe2+和Cr3+还原性强弱 | 比较碳酸钠与碳酸氢钠的热稳定性 | 制备氢氧化铁胶体 |
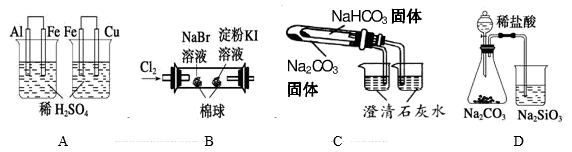
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
|
|
|
|
|
|
A.比较Na2CO3、NaHCO3的稳定性 |
B.排空气法收集CO2 |
C.钠的燃烧 |
D.溶液滴加 |
a.氧化物 b. 酸 c. 碱 d. 盐
【实验1】 加热碳酸氢钠固体,装置如下图所示。

①利用上述装置可实现NaHCO3向 Na2CO3发生转化,试管中发生反应的化学方程式为。
【实验2】 分别向滴有2滴酚酞的NaHCO3和Na2CO3溶液中滴加稀盐酸,实验记录如下:
实验内容 | 实验现象 |
实验2-1 | 溶液浅红色褪去,立即产生大量气泡。 |
实验2-2 | 开始时,溶液的红色没有明显变化,也没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量也逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。 |
②实验2-1中,反应的离子方程式是
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是。
④通过上述实验,从物质组成上分析Na2CO3转化为NaHCO3 , 加入盐酸的作用是;碳酸也可实现上述转化,写出将CO2通入Na2CO3溶液中发生反应的化学方程式:。
资料i:
物质 | NaCl | NaHCO3 | NH4HCO3 | NH4Cl |
20℃时的溶解度(g/100gH 2O) | 36.0 | 9.6 | 21.7 | 37.2 |
资料ii:氨气(NH3)可与水发生反应,生成一水合氨(NH3∙H2O),一水合氨属于一种碱。
①向饱和NaCl溶液中通入足量CO2 , 无NaHCO3生成,原因是。
②向饱和NaCl溶液中先通入NH3 , 再通入CO2 , 在溶液中可析出NaHCO3晶体,该反应的化学方程式,通入NH3的作用是。
如图:Ⅰ中浅红色褪去,且立即产生大量气泡;Ⅱ中开始无气泡,溶液颜色由红色变为浅红色,最后出现大量气泡.

①浓度相同时,碱性(填“>”或“<”)。
②Ⅱ的反应过程出现的证据是,其离子反应的方程式。
①用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和。
②计算需要固体的质量是g。
③下列情况中,会使所配溶液浓度偏高的是(填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
已知:ⅰ.极易溶于水并生成碱,与酸反应生成盐,如
。
ⅱ.有关物质的溶解度
物质 | ||||
溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
沉淀池中主要沉淀物(化学式),发生反应的化学方程式为。
Na2CO3和 NaHCO3均为色的固体,
编号 | 实验内容 | 实验数据或者现象 |
实验I | 利用传感器探究两种物质分别溶水时的温度变化
|
|
实验II | 探究两种物质得到热稳定性
| 一段时间后,A中无明显现象,B中… |
实验III | 探究两种物质分别与盐酸反应
| A中开始无大量气泡,一段时间后产生大量气泡;B中立即产生大量气泡。 |
实验II试管B中的现象为。
实验I所得实验数据证明,溶解时吸收热量的物质是。
第一步:CO+ H+=HCO
;第二步: 。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:I.溶液温度升高;II.(填字母序号)。
a.滴入酚酞后呈浅红色 b.滴入酚酞后呈红色
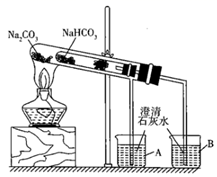
①整个实验过程中,能观察到烧杯B中的现象是;
②实验结束时的操作是。
③写出实验过程中试管中发生反应的化学方程式:。
④该实验可证明NaHCO3的热稳定性(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?(填“能”或“不能”)。
⑤能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是。

A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.两支试管中均盛有3mL6mol/L稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
⑥下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是。
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体

已知:NaHCO3+NaOH=Na2CO3+H2O;
请回答:

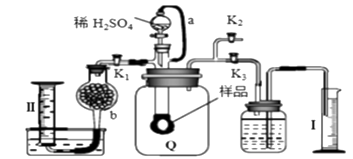
①装置II中物质的化学式是。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,所需仪器装置是__(从图中选择必要装置,填写编号)。
序号 | 操作 | 现象 | |
Na2CO3 | NaHCO3 | ||
① | 在两支试管中加入1g Na2CO3或1g NaHCO3 , 再加入5mL水,振荡;将温度计分别插入其中 | 温度由17.6℃变为23.2℃;放置至室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置至室温时,试管内有少量固体残留 |
② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液微红 |
室温下,Na2CO3的溶解度大于NaHCO3的实验证据是。
测量下述实验过程的pH变化,实验操作及实验现象如下。
资料:pH越小,c(OH-)越小,溶液碱性越弱。
实验操作 | 实验现象 |
| Ⅰ.②和③中均产生白色沉淀。 Ⅱ. |
澄清石灰水显碱性,用电离方程式表示其原因是。



方法①:如图所示装置,这是根据它们具有不同的稳定性加以鉴别的。实验过程中,当试管B中盛放的澄清溶液出现白色浑浊时,试管A中发生反应的化学方程式是。
方法②:取等物质的量的苏打和小苏打分别于试管中,再分别加入足量盐酸充分反应,比较相同条件下收集到的气体的体积。请写出相关反应的离子方程式: 、。

请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是。
②该工艺流程中可回收再利用的物质是。
③若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行的是(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
 B .
B .  C .
C .  D .
D . 

![]()
回答下列问题:
①Na2CO3溶液由无色变为红色,其原因是.
②NaHCO3溶液也由无色变为红色,其原因是.
③比较两份溶液的颜色,红色较浅的是(填化学式).
实验序号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
①实验1中没有出现白色浑浊的原因是.
②实验2中形成的分散系属于.
③用离子方程式表示实验2中发生的反应.


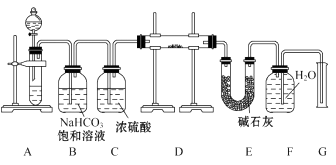
a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行