目的 | 方案设计 | 现象和结论 | |
A | 检验硫酸厂周边空气中是否含有二氧化硫 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化 | 溶液不变色,说明空气中不含二氧化硫 |
B | 鉴定某涂改液中是否存在含氯化合物 | 取涂改液与KOH溶液混合加热充分反应,取上层清液,硝酸酸化,加入硝酸银溶液,观察现象 | 出现白色沉淀,说明涂改液中存在含氯化合物 |
C | 检验牙膏中是否含有甘油 | 将适量牙膏样品与蒸馏水混合,搅拌,静置一段时间,取上层清液,加入新制的Cu(OH)2 , 振荡,观察现象 | 溶液出现绛蓝色,说明牙膏中含有甘油 |
D | 鉴别食盐与亚硝酸钠 | 各取少量固体加水溶解,分别滴加含淀粉的KI溶液,振荡,观察溶液颜色变化 | 溶液变蓝色的为亚硝酸钠;溶液不变蓝的为食盐 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
| B | 室温下,向 | 镁与盐酸反应放热 |
| C | 室温下,向浓度均为 | 白色沉淀是BaCO3 |
| D | 向 | H2O2具有氧化性 |
| 实验操作 | 现象 | 结论 | |
| A | 向硫代硫酸钠溶液中滴加稀硫酸 | 产生黄色沉淀和刺激性气味气体 | 硫代硫酸钠既有氧化性又有还原性 |
| B | 将足量硼酸溶液滴入到碳酸钠溶液中 | 无气泡 | 酸性:H2CO3>H3BO3 |
| C | 向FeCl3和KSCN的混合溶液中加入KCl溶液 | 溶液红色变浅 | 增大生成物的浓度,平衡向逆反应方向移动 |
| D | 一定温度下,向10mL0.1mol·L-1NaOH溶液中滴入10mL0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1CuCl2溶液 | 先有白色沉淀生成,后出现蓝色沉淀 | 相同温度下,Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |

选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油蒸汽通过炽热碎瓷片后,产物通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 该反应中有还原性物质生成 |
B | 向25mL沸水中加入5~6滴0.1mol/LFeCl3溶液,继续加热 | 溶液变成红色 | 有氢氧化铁胶体生成 |
C | 1mL20%蔗糖溶液中加入几滴稀硫酸并加热,然后加入新制Cu(OH)2煮沸 | 产生红色沉淀 | 蔗糖水解生成葡萄糖 |
D | 向AgCl悬浊液中先滴加0.1mol/LKI 溶液,再滴加0.1mol/LNa2S溶液 | 白色沉淀先变为黄色,后变为黑色 | Ksp(AgCl)<Ksp(AgI) <Ksp(Ag2S) |

选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.1 mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |

选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
选项 | 操作 | 目的 |
A | 乙醇与浓硫酸加热至170℃,将产生的气体通入酸性高锰酸钾溶液 | 验证产物乙烯具有还原性 |
B | 向粗盐水中依次加入过量的BaCl2、NaOH、Na2CO3溶液,静置过滤,最后向滤液中滴加盐酸至无气泡产生 | 精制食盐水 |
C | 将醋酸与碳酸钠溶液反应后产生的气体通入苯酚钠溶液中 | 比较醋酸、碳酸、苯酚酸性 |
D | 淀粉溶液中加入几滴稀硫酸,水浴加热,充分反应后加入NaOH溶液调节至碱性,再加入银氨溶液,水浴加热· | 检验淀粉水解产物含有醛基 |
实验目的 | 实验操作 | |
A | 除去苯中混有的苯酚 | 向混合液中加入NaOH溶液,充分振荡后,分液 |
B | 检验溴乙烷中的溴元素 | 向溴乙烷中加入少量AgNO3溶液,振荡静置 |
C | 证明CH2=CHCHO中含有碳碳双键 | 向CH2=CHCHO中滴入酸性KMnO4溶液 |
D | 区分苯、乙醇、CCl4三种无色液体 | 分别向三种无色液体中滴加溴水,振荡静置 |
HNO3用量 | 少量稀硝酸 | 足量稀硝酸 | ||||
分组 | 试管1 | 试管2 | 试管3 | 试管4 | 试管5 | 试管6 |
操作 | 加淀粉溶液 | 加KSCN溶液 | 加淀粉溶液 | 加KSCN溶液 | 加淀粉溶液 | 加KSCN溶液 |
现象 | 变蓝 | 未变红 | 变蓝 | 变红 | 变蓝 | 未变红 |
实验目的 | 玻璃仪器 | 试剂 | |
A | 检验 | 试管、胶头滴管、酒精灯 |
|
B | 制备无水乙醇 | 蒸馏烧瓶、牛角管、酒精灯、冷凝管、锥形瓶 |
|
C | 实验室制备乙烯 | 酒精灯、圆底烧瓶、温度计、导气管、胶头滴管 | 浓硫酸、乙醇碎瓷片 |
D | 除去苯中少量的苯酚 | 普通漏斗、烧杯、玻璃棒 | 浓溴水 |
选项 | 操作 | 现象 | 结论 |
A | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液加入AgNO3溶液 | 产生淡黄色沉淀 | CH3CH2Br中含有溴原子 |
B | 向2 mL10%的NaOH溶液中滴入2%的CuSO4溶 液4至6滴,得到新制的Cu(OH)2悬浊液,然后加入乙醛溶液0.5 mL,振荡后加热 | 产生砖红色沉淀 | 醛基具有还原性 |
C | 将乙醇与浓硫酸共热至170℃所得气体直接通入酸性KMnO4溶液中 | KMnO4溶液褪色 | 乙醇发生消去反应的产物为乙烯 |
D | 向苯酚钠溶液中通入一定量CO2 | 溶液变浑浊 | 碳酸的酸性比苯酚的酸性强 |

I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
实验原理:
实验步骤:

判断 沉淀完全的操作为。
实验原理: ,

实验步骤:
①按上图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
步骤②为。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为。

某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1 , 反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为。
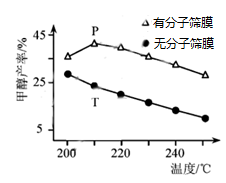
①甲醇平衡产率随温度升高而降低的原因为。
②P点甲醇产率高于T点的原因为。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为℃。
的空间构型为。已知25℃碳酸电离常数为Ka1、Ka2 , 当溶液pH=12时,
=1::。
原料环己醇中若含苯酚杂质,检验试剂为,现象为。
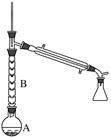
①烧瓶A中进行的可逆反应化学方程式为,
浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为。
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2 , 与环己烯充分反应后,剩余的Br2与足量KI作用生成I2 , 用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
滴定所用指示剂为。样品中环己烯的质量分数为(用字母表示)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化

①其中A装置中的固体变为红棕色,则固体产物中含有;C装置中红色褪去,说明气体产物中含有。
②为验证A中残留物是否含有FeO,需要选的试剂有。
A.KSCN溶液
B.浓盐酸
C.KMnO4溶液
D.稀硫酸
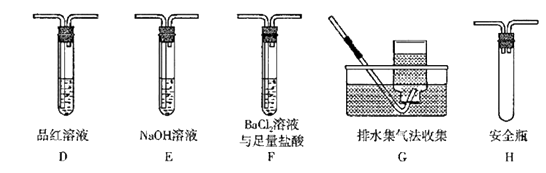
①丁同学的实验中,装置依次连接的合理顺序为A、。
②装置F中,足量盐酸的作用是。

已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2 , 不吸收NO。
装置A中反应的离子方程式是。

回答下列问题:
仪器B的名称是仪器B冷却水的进口为(填“a”或“b”)活性炭的作用是。

回答下列问题:
①能证明钠的密度比水小的现象是。
②能证明钠的熔点低的现象是。
③能证明有氢氧化钠生成的现象是。
④能证明有气体产生的现象是A端液面B端液面(填“高于”、或“低于”)

已知:①(棕色);
②都是难溶于水、难溶于稀硫酸的黑色固体。
实验中,观察到B中红色溶液变无色,C中产生白色沉淀,D中溶液变棕色。铜粉完全反应后,观察到烧瓶底部有灰白带黑色固体。
猜想1:白色固体是;
猜想2:白色固体是(填化学式);
猜想3:白色固体是和
。
为了确认白色固体成分,取少量白色固体于试管中,加入足量盐酸,白色固体不溶解且无气泡生成。由此推知,猜想(填数字)合理。
①若过量或恰好完全反应,则发生的离子反应为
;若
少量,则发生的离子反应为。
②设计实验证明C中盛装的是否过量:。
①分离应选择的合理操作是(填标号),过滤,得到蓝色溶液和黑色固体。
a.向混合物中加入蒸馏水,搅拌,静置
b.将混合物倒入盛有水的烧杯中,搅拌,静置
②黑色固体不可能是(填标号),判断依据是。
A. B.
C.
③探究上述黑色固体成分。

取所配制的溶液于锥形瓶中,滴几滴试剂R,用
的
标准溶液滴定至终点,消耗滴定液
。R是(填名称)。根据上述相关实验结果,X是(填化学式)。
②实验室利用装置 A 制氯气,反应的离子方程式是 。
①装置 E 的作用是。
②虚线框可选用下列装置中的(填“甲”“乙”或“丙”)。

①F、G 通入Cl2 后,观察到的现象是,根据现象可得出结论: Cl2 无漂白性, Cl2 与水反应生成的HClO 有漂白性。
②实验开始后,观察到洗气瓶 H 中的现象是。
③请设计一个实验,证明洗气瓶Ⅰ中的亚硫酸钠已被氧化(简述实验操作):
。
④装置 K 的作用是。

如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③用惰性气体排出装置中的空气等……
注:CuO能将烃氧化成和
;
是烷烃裂解的催化剂;G后面装置已省略。
I.碳化铝(Al4C3)与水反应可制得CH4。
II.银氨溶液{含[Ag(NH3)2]+、OH-与CO反应产生银镜(Ag)。
III.CH4被CuO氧化的氧化产物为CO和CO2。
某学习小组对III表示质疑并在老师的指导下进行实验探究。回答下列问题:


A中反应的离子方程式是,D中溶液的作用是。

取白色沉淀,加入稀盐酸,没有明显变化,推测沉淀是。