






| ① | ② | ③ |
| | | |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
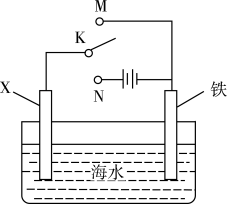
下列说法错误的是( )
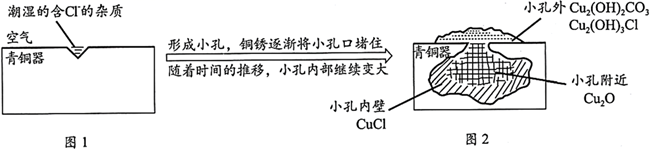
已知:2CuCl+H2O Cu2O+2HCl
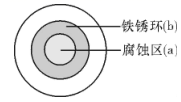
下列分析错误的是( )



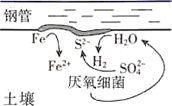
实验步骤如下:
步骤1:将铁粉放置于0.002
溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

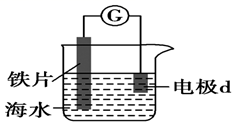
第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
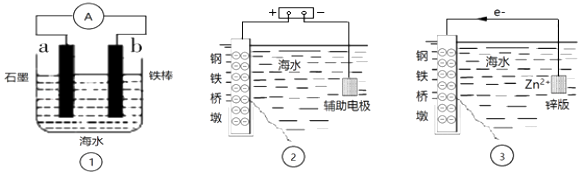
在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将
转化为
, 电解得到的镀层更加致密、细腻,原因是。
①滴定终点的现象是。
②废水中的含量是
(填计算式)。