




[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
下列关于工业合成氨的说法不正确的是(填标号)。
A.因为 , 所以该反应一定能自发进行
B.采用高压是为了增大反应速率,但会使反应物的转化率降低
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂增大反应速率是因为催化剂降低了反应的活化能
a.容器内、
、
的浓度之比为1∶3∶2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变

请用平衡移动原理解释在工艺流程中及时分离出氨气和将分离后的原料气循环使用的原因。
①图中和
的关系:
(填“>”“<”或“=”)
。
②a、b、c、d四点所处的平衡状态中,的转化率最高的是(填字母)。

时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数。
②若维持容器容积不变,温度不变,向原平衡体系中加入、
和
各4mol,化学平衡将向(填“正”或“逆”)反应方向移动。
写出氨气催化氧化生成NO和水蒸气的热化学方程式。



①吸附后,能量状态最高的是(填序号)。
②结合上述原理,在固体Fe催化剂表面进行的分解实验,发现
的分解速率与其浓度的关系如图3所示。从吸附和解吸过程分析,
之后反应速率降低的原因可能是。
③研究表明,合成氨的速率与相关物质的浓度的关系为 , k为速率常数。能使合成氨的速率增大的措施有(填序号)。
A.使用更有效的催化剂
B.一定温度下,将原容器中的及时分离出来
C.总压强一定,增大的值
D.按照原来比值增大反应物的浓度

①图像中T2和T1的关系是:T1T2(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是:。
③ 合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是 。
①20min后,反应达平衡,氨气的浓度为0.3 mol·L -1 , 用N2表示的平均反应速率为mol/(L·min)。且此时,混合气体的总压强为p,则该反应的化学平衡常数Kp= [对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入1.8mol N2和4.2mol H2 , 再次达平衡后,氨气的浓度0.6 mol·L -1(填“大于”或“小于”或“等于”)。

相关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
从结构上解释N2化学性质稳定的原因。上述固氮反应的化学方程式是。固氮的适宜温度范围是。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3 , 且产物MgCl2能直接循环利用,但NH3的收率较低,原因是。
活性炭还原NO2的原理为2NO2(g)+2C(s)N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2O4)。实验测得NO2的转化率与时间的关系如图所示:

a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变

①N2的体积分数随温度升高先减小后增大的原因是。
②研究表明,温度越高,温度对平衡的影响大于压强对平衡的影响。保持其他条件不变,请在上图中画出P2压强下 (P2>P1)N2的体积分数与温度(T)的关系趋势图。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
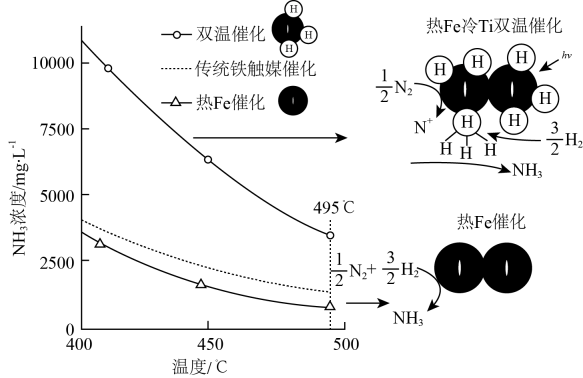
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

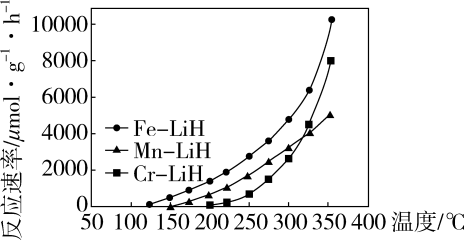
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率

①流程中,有利于提高原料利用率的措施是;有利于提高单位时间内氨的产率的措施有。
②干燥净化中,有一步操作是用铜氨液除去原料气中的CO,其反应为:。对吸收CO后的铜氨废液应该怎样处理?请提出你的建议:。

①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。

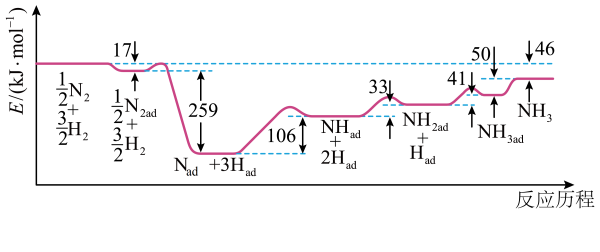
①写出该反应的热化学方程式
②图中曲线(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是。

根据生产流程示意图,请回答下列问题:
①合成氨工业中循环利用的物质有(填化学式),采用循环操作主要是为了。
②工业合成氨采取了下列措施,其中能提高氨气的产率是(填编号)。
A.用铁触媒作催化剂 B.选择400℃至500℃的温度
C.用压缩机加压 D.冷却并分离出液态氨

①图像中T2和T1的关系是:T2T1(填“ ”“
”“
”或“无法确定”)。
②在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是(填字母)。
③若容器容积为2L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为 mol/L。