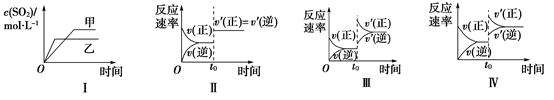
2Fe3+(aq)+2I-(aq) ![]() 2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )
2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )

反应过程中的部分数据如下表所示:
| n/mol t/min | n(A) | n(B) | n(C) |
| 0 | 4.0 | 1.0 | 0 |
| 2 | 0.6 | 0.2 | |
| 4 | 0.4 | ||
| 6 | 2.8 | 0.3 |
下列说法正确的是( )
| 物质 | X | Y | Z |
| 起始浓度/( | 0.1 | 0.2 | 0 |
| 平衡浓度/( | 0.05 | 0.1 | 0.1 |

| 编号 | 化学方程式 | 温度 | |
| | | ||
| Ⅰ | | 1.47 | 2.15 |
| Ⅱ | | 1.62 | b |
| Ⅲ | | a | 1.68 |
根据以上信息判断,下列结论正确的是( )
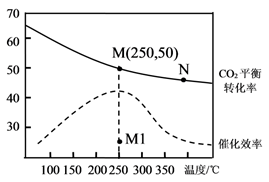


| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
| SO2 | O2 | SO3 | ||||
| Ⅰ | 恒温恒容 | 1.0L | 2 | 1 | 0 | 1.6 |
| Ⅱ | 绝热恒容 | 1.0L | 2 | 1 | 0 | a |
| Ⅲ | 恒温恒压, | 0.5L | 0 | 0 | 1 | b |
| 容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
| HCl | O2 | Cl2 | H2O | |||||
| I | 恒温恒容 | 1L | | 4 | 1 | 0 | 0 | 1 |
| II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
| III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
| 容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
| CH4 | H2O | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
| Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |

下列说法错误的是( )
| 加入的物质 | 氯化铵 | 氨气 | 氢氧化钠 |
| 平衡移动方向 |
|
|
|
步骤1.在三口烧瓶中加入3.5g(0.025mol)水杨酸  、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。

步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。
步骤3.有机相依次用水、10%Na2CO3溶液、水洗涤。
步骤4.干燥,蒸馏并收集221~224℃馏分。
①图中仪器W的名称是。
②步骤3,第一次水洗的主要目的是;第二次水洗的目的是。
③合成水杨酸甲酯的化学方程式为;实验中加入过量甲醇的目的是。
(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 平衡常数K1
(Ⅱ)CO(g)+2H2(g) CH3OH(g) ΔH2 平衡常数K2
(Ⅲ)CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 平衡常数K3
维持 =75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:

①平衡常数K3=(用K1、K2表示);△H10(填“>"或“<”)。
②下列叙述正确的是 (填标号)。
A.催化剂Cu/ZnO不能催化反应(I)
B.催化剂Cu/ZnO在温度低于480K时活性很低
C.图中a点所示条件下,延长反应时间能提高甲醇的产率
D.图中b点所示条件下,若增加H2的浓度不能提高甲醇的产率
③400K时向某恒容密闭容器中充入CO和H2 , 使c(CO)=0.10mol·L-1 , c(H2)=0.20mol·L-1 , 且只发生反应(II);平衡时c(CH3OH)=0.08mol·L-1。该温度下反应(II)的平衡常数为。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)25℃时,K=2.95×1011①
2CO(g)+4H2(g) CH3CH2OH(g)+H2O2(g)25℃时,K=1.71×1022②
根据表中数据分析:
|
温度(K)CO2/转化率(%)n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
22 |
①温度升高,K值(填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)],K值填“增大”、“减小”或“不变”),对生成乙醇(填“有利”或“不利”)
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH= - 246.4kJ·mol-1
它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1= - 205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2 = 。
问:①该反应的平衡常数表达式为:
②反应开始时正、逆反应速率的大小:v(正)v(逆)。(填“>”、“<”或“=”)
③平衡时CO的转化率=。
,
表示CO2的平衡压强,
,
,
天然雨水的pH<7,用电离方程式解释其原因。
:。
反应1(甲醇合成):
反应2(甲醇脱水):
反应3(逆水汽变换):
相关物质变化的焓变示意图如下:
| | |
| | |
| | |
| |
双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成。在一定条件下,将CO2与H2以1:3体积比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图1所示。

写出反应3的热化学方程式。
反应Ⅰ:
反应Ⅱ:
总反应Ⅲ:
①反应Ⅰ的 kJ/mol。
②一定温度下,恒容的密闭容器中按化学计量数比投料进行反应Ⅲ,下列能说明反应Ⅲ达到化学平
衡状态的是。
A.容器内气体总压强不再变化 B. 与
的浓度相等
C. D.
保持不变

①b点v(正)v(逆)(填“>”、“<”、“=”)
②温度为 时,该反应的平衡常数K=。
③若某温度下反应已达平衡,下列措施中有利于提高 平衡转化率的是。
A.使用高效催化剂 B.不断分离出产物
C.提高原料气中 的比例 D.升温
A.利用催化剂可以使反应的平衡常数增大
B.CH4→CH3COOH过程中,有C-H键发生断裂
C.有22. 4LCH4参与反应时转移4mol电子
D.该反应为放热反应

①若H2(g)和CH3OH(l)的燃烧热分别为285.8kJ●mol-1和726.5kJ●mol-1 , 则由CO2和H2生成液态甲醇和液态水的热化学方程式为。此反应的活化能Ea(正)Ea(逆)(填“>”或“<”),该反应应选择高效催化剂(填“高温”或“低温”)。
②下列措施能使CO2的平衡转化率提高的是(填序号)。
A.增大压强 B.升高温度 C.增大H2与CO2的投料比 D.改用更高效的催化剂
③200℃时,将0.100molCO2和0.200molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若平衡时CO2的转化率为50%,则此温度下该反应的平衡常数K=(已知CH3OH的沸点为64.7℃)。