 B .
B .  C .
C .  D .
D . 
 B . 称量 7.2g 氧化钠
B . 称量 7.2g 氧化钠  C . 量取 32.8mL 水
C . 量取 32.8mL 水  D . 玻璃棒搅拌溶解
D . 玻璃棒搅拌溶解 


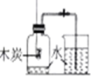 测定空气中氧气的含量
B .
测定空气中氧气的含量
B . 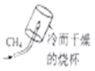 探究甲烷中是否含碳元素
C .
探究甲烷中是否含碳元素
C .  验证质量守恒定律
D .
验证质量守恒定律
D . 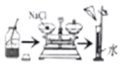 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液
 C . 漏斗
C . 漏斗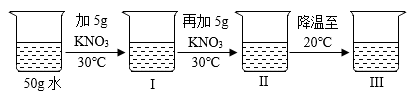


①计算:需要称取NaCl的质量是g。
②配制溶液的操作步骤如上图,正确的操作顺序是(填字母序号)。
常温下(20℃)溶解度和溶解性的关系
|
溶解度S |
S≥10g |
1g≤S<10g |
0.01g≤S<1g |
S<0.01g |
|
溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
①常温下(20℃),KNO3和NaCl的溶解性都属于。
②80℃时,KNO3的溶解度(填“大于”、“小于”或“等于”)NaCl的溶解度。
③从该混合物中分离出KNO3的方法是。

水——化学变化的参与者
①写出水与生石灰反应的化学方程式。
②列举一条该反应的用途。


温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
NaCl的溶解度/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
NH4Cl的溶解度/g | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |

温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
溶解度/g | 氯化钾 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
次氯酸钠 | 22.7 | 26.7 | 34.8 | 50.0 | 52.4 | 56.5 | |
①0℃时,100g水里最多只能溶解g氯化钾。
②30℃时,将30g次氯酸钠加入到装有50g水的烧杯中,充分溶解后,所得溶液的质量是g。将此溶液恒温蒸发10g水,烧杯中固体的质量为g。
③50℃时,将氯化钾和次氯酸钠的饱和溶液各100g分别降温至20℃,两溶液中溶质的质量大小关系是:氯化钾次氯酸钠(填“大于”“等于”或“小于”)。

【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向10L水中加入25g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100mL水和5g硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 | 水样的体积/mL | 加入絮凝剂溶液的体积/mL | 静置时间/min | 浊度去除率/% |
① | 200 | 0 | 20 | 12.48 |
② | 200 | 0.2 | 20 | 76.54 |
③ | 200 | 0.3 | 20 | 84.60 |
④ | 200 | 0.4 | 5 | 64.45 |
⑤ | 200 | 0.4 | 10 | 70.85 |
⑥ | 200 | 0.4 | 15 | 81.04 |
⑦ | 200 | 0.4 | 20 | 86.02 |
⑧ | 200 | 0.5 | 20 | 88.15 |
⑨ | 200 | 0.6 | 20 | 86.49 |
【解释与结论】
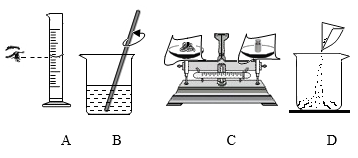
正确的操作顺序是(填序号),B中用玻璃棒搅拌的目的是。
依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是。

装置B中仪器甲的名称是。

用溶质质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制溶质质量分数为5%的氯化钠溶液60克。
计算需要6%的氯化钠溶液的体积是。(结果保留整数)
化学兴趣小组发现,实验室有一瓶装满生石灰的塑料瓶已经膨胀且破裂。
为探究破裂处生石灰变质的情况,同学们设计了如下实验。
实验燥作 | 实验现象 | 实验结论 | |
① | 取少量瓶中破裂处的白色固体于烧杯中,加入足量的水,用手触摸烧杯外壁,然后过滤,得到滤渣和滤液 | 烧杯壁无发热现象 | |
② | 取①中少量滤液于试管中,向其中加入一定量的Na2CO3溶液 | 有Ca(OH)2 | |
③ | 取①中少许滤渣于试管中,向其中加入适量的稀盐酸 | 有气泡产生 |
实验结论:由上述实验可确定所取白色固体的成分。
④将②③两支试管中所有物质倒入一洁净干燥的烧杯中静置,则上层清液中一定含有的离子是。(填离子符号)
【查阅资料】影响化学反应速率的因素有很多,如:使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图组装,在室温下分别进行了四组实验,并用O2传感器测定实验过程中O2含量的变化情况,得到如下图所示曲线。
组别 | 试剂 |
第1组 | 2mL 5% H2O2 |
第2组 | 2mL 5% H2O2 + 3滴FeCl3溶液 |
第3组 | 2mL 5% H2O2 + 3滴CuSO4溶液 |
第4组 | 2mL 5% H2O2 +少量MnO2粉末 |


【实验结论】对比四条曲线,进行分析:
温度 H2O2% | 50℃ | 60℃ | 70℃ |
5% | 无明显气泡 | 无明显气泡 | 极少量气泡 |
10% | 无明显气泡 | 无明显气泡 | 少量气泡 |
15% | 无明显气泡 | 少量气泡 | 较多气泡 |

①用图中仪器完成实验,还缺少的玻璃仪器是(填名称),玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)
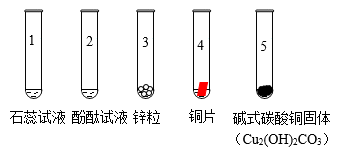
①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。
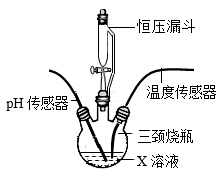
①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是,实验进行到60s时溶液中的溶质为(填化学式)。

②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
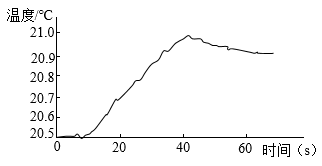
③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是。

②装置C中试剂X应该选用(填字母)。
a.稀H2SO4 b.浓H2SO4 c.KOH溶液


①检验装置D中CO2已经集满的方法是。
②随着反应的进行,锥形瓶中压强降低的原因是。
③反应结束后锥形瓶中的压强保持在40kPa说明。

【查阅资料】
材料一:溶液的导电力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca(OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca(HCO3)2 , Ca(HCO3)2在水中能完全解离出Ca2+和;。
①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是。
②反应最终电导率的稳定值低于初始值的可能原因是、。
可供选择的试剂有:NaOH溶液、KOH溶液、BaCl2溶液。
该小组的同学称取固体样品20g,向其中加入135.9g水全部溶解,再加入40g所选试剂,恰好完全反应,得到Na2SO4溶液和4.9g沉淀。回答并计算:
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
锥形瓶+瓶内物质的总质量/g | 375.00 | 371.56 | 366.28 | 365.56 | 365.40 | 365.40 | 365.40 |