

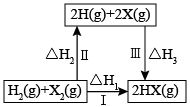
已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
II. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 = kJ ·mol-1。
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1 , 反应I自发进行的最低温度T=K。
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是。
①CH3- CH3→CH3- CH2·+ H++e- ,
②CH3-CH2·→CH2=CH2+H++e- ,
③CO2+e-→ ,
④+ H+→·COOH,
⑤ ,
则:自由基CH3-CH2·的电子式为 ,⑤的反应式为。
①其他条件相同时,1mol C2H6与1mol CO2经相同反应时间测得如表实验数据:
|
实验 |
温度/K |
催化剂 |
C2H4的产率% |
|
实验1 |
400 |
催化剂1 |
55.0 |
|
400 |
催化剂2 |
62.3 |
|
|
实验2 |
500 |
催化剂1 |
68.5 |
|
500 |
催化剂2 |
80.1 |
在催化剂相同时,温度越高C2H4产率更高的原因是 ; 相同温度时,催化剂2催化下C2H4产率更高的原因是。
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是 ;M点主反应的平衡常数为(结果保留2 位有效数字)。

①
;
②
;
③
。
试回答:
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图

CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号),理由是。

综合以上分析,为抑制积炭产生,应选用高温、低压条件。
该反应可以储能的原因是。
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
序号 | 加热温度/℃ | 反应物气体流量/L·min-1 | CH4/CO2 | XCH4/% | ηchem/% |
① | 800 | 4 | 2:2 | 79.6 | 52.2 |
② | 800 | 6 | 3:3 | 64.2 | 61.9 |
③ | 800 | 6 | 2:4 | 81.1 | 41.6 |
气体流量越大,CH4转化率越低,原因是:随着流量的提高,反应物预热吸热量增多,体系温度明显降低,。
化学键 | H—H | C=O | H—O | C—H | C—O |
E(kJ/mol) | 436 | 745 | 465 | 413 | 351 |
写出二氧化碳催化加氢制甲醇的热化学方程式。

①该过程容易产生副产物。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:。
反应a:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1;
反应b:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0。
在传统的催化固定反应床(CFBR)中,CO2转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(MR)用于CO2催化加氢制备甲醇,极大地改善了该问题,原理如图所示。

保持压强为5MPa,向密闭容器中投入一定量CO2和H2 , 不同反应模式下CO2的平衡转化率和甲醇选择性的相关实验数据如表所示。
实验组 | 反应模式 | 压强/MPa | 温度/℃ | CO2转化率 | CH3OH选择性 | |
① | CFBR | 3 | 5 | 250 | 25.6 | 61.3 |
② | CFBR | 3 | 5 | 230 | 20.0 | 70.0 |
③ | CMR | 3 | 3 | 260 | 36.1 | 100 |
已知CH3OH选择性:转化的CO2中生成CH3OH的百分比。
CFBR模式时,投料比=3一定温度下发生反应,下列说法能作为反应a达到平衡状态的判据是____(填选项字母)。
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则
=。


①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“
”或“
”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | H2(g)+ | 685 | 970 |
② | 2CH3OH(1) + 3O2(g)=2CO2 (g) +4H2O (1) | 3526 | 4978 |
CO2与H2合成液态甲醇的热化学方程式为。

①0~ 20 min内,用CH3OH的浓度变化表示的平均 反应速率:v(CH3OH)= mol·L-1·min-1。
②该温度下,反应的平衡常数K= (结果保 留两位小数)。
③若在上述平衡状态下,再向容器中充入1mol CO2和1molH2O(g),则反应速率 v(正)v(逆) (填“>”“< “或“= “)。


则合成氨反应的热化学方程式为。

前20min内 , 放出的热量为,25min时采取的措施是。
①该反应的平衡常数是。
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol , 则此时平衡(填“正向移动”“逆向移动”或“不移动”)
①298K,101kPa下,下列反应
则反应能自发进行的条件是。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)。
A.在制备阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在转化为
阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
①某温度下,假设进入接触室内的物质的量恒定。当
和
的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使
的平衡转化率提高到90%,则
和
的物质的量比为应为(计算结果保留1位小数)。
②催化氧化
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:。
步骤Ⅲ:
当稀释时,
的值(增大、减小或不变),理由是。
①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH= kJ·mol-1。
+
关于该反应的下列叙述正确的是(填标号)。
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
+
300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是、,判断的理由是。
i:CO (g) + 2H2(g)⇌CH3OH (g) ΔH1=- 90. 1KJ/ mol
ii:2CH3OH (g)⇌CH3OCH3(g)+ H2O(g) ΔH2=- 24.5KJ/mol
则总反应的ΔH= ; 若反应过程中能量变化如图所示,则总反应速率主要由反应 (选填“i ”或“ii”)决定。

a.升高温度 b.增大压强 c.使用合适催化剂 d.及时分离二甲醚

①反应在100℃,5. 0 ×105Pa时,CO的平衡转化率α= ,判断依据是 ,该条件下的平衡体系中二甲醚的体积分数约为 %(保 留小数点后一位)。
②一定温度下,同一反应用平衡浓度表示的平衡常数Kc和用平衡分压表示的平衡常数Kp间存在定量关系,可以借助公式pV= nRT进行推导(其中T为体系温度;p为气体压强;V为气体体积;n为气体物质的量;R为常数)。则当体系温度为T时,总反应Kc与Kp的关系为Kc=Kp(用含 R、T的式子表示)。
反应Ⅰ:CO2(g)+H2(g)H2O(g)+CO(g) △H1
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) △H2=-90.0kJ·mol-1
反应Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
反应Ⅳ:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
反应Ⅴ:2CO2g)+6H2(g)C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
回答下列问题:
温度/K CO2转化率 | 500 | 600 | 700 | 800 |
1 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 40 | 22 |
①下列说法中正确的是(填英文字母)。
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是(填英文字母)。
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断

①该催化剂在较低温度时主要选择反应(“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是:。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=L2/mol2(保留两位小数)。

该反应能自发的条件是(填“低温”或“高温”)。

①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②t=250℃时,当x(CH3OH)=0.10时,的平衡转化率
,(保留小数点后一位)此条件下该反应的Kp=。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。

合成氨反应的热化学方程式为。
①SO2(g)+2NH3·H2O(aq)=(NH4)2SO3(aq)+H2O(l) △H1
②(NH4)2SO3(aq)+SO2(g)+H2O(l)=2NH4HSO3(aq) △H2
③2NH4HSO3(aq)+2NH3·H2O+O2(g)=2(NH4)2SO4(aq)+2H2O(l) △H3
则2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=。
A.SO3和NO的浓度比保持不变
B.混合气体的颜色保持不变
C.容器中压强不再变化
D.恒容混合气体的密度保持不变

①达到平衡后,仅升高温度,k正增大的倍数(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,总压为a,在一定温度下达到平衡时,CO的转化率为50%,则=;在t1min时再向容器内加入1molCO和1molNO,保持温度不变,则再次达平衡时NO的转化率(填“增大”“减小”或“不变”)。整个过程中容器中的气压(P)与反应时间(t)的关系曲线如图所示,则用平衡分压代替平衡浓度表示的压强平衡常数Kp=。
