

| A | B | C | D |
| | | | |
| 酸性重铬酸钾用于检测酒精 | 铝粉与强碱溶液反应放热 | 植物油在空气中变质,产生“哈喇”味 | 海水经风吹日晒获得粗盐 |

该小组将100.00mL海水样品蒸发结晶,得到乳白色粗盐晶体m1g,若要检验该粗盐中是否含有硫酸根离子,方法是。取一半该粗盐,若将SO转化成硫酸钡沉淀,如何判断SO
已沉淀完全;洗涤干燥后,称量得到0.0233g沉淀,则该海水中SO
的含量为mol/L,若未洗涤,则测得结果(填“偏大”、“偏小”或“无影响”)。

步骤⑤操作中用到的玻璃仪器有,实验过程中多次产生沉淀,共需要过滤次。若m2=1.346g,据此能否计算该海水样品中的氯化钠的物质的量浓度?若能,请写出计算结果;若不能,请解释原因:。
请对比该小组设计的两种制备装置甲和乙,你认为哪种装置更好,请说明理由。

①铝土矿中 的晶体类型;
②比较 的简单离子半径大小;
③ 最外层电子的电子云形状为。
吸收塔中反应的离子方程式是,工业生产1mol高浓度Br2 , 理论上需要Cl2的物质的量为。
上述流程中为了使MgSO4完全转化为Mg(OH)2 , 试剂①可以选用(写化学式)。
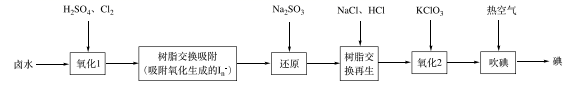
①“氧化1”中生成 ,其反应的离子方程式为。
②“还原”中溶液里含有 , 检验
的实验操作是。
③“吹碘”中通入热空气,利用了碘具有的性质。
已知反应: +5I-+6H+=3I2+3H2O,实验中可选用的试剂:2mol·L-1硫酸、1 mol·L-1KI溶液、淀粉溶液、CCl4。
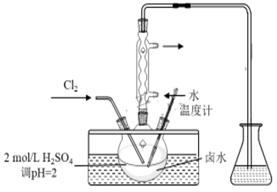
①取2.500L卤水样品减压浓缩至20.00mL,加入过量的0.1500mol·L-1CuCl2溶液20.00mL。
②密封静置2h,生成白色沉淀(发生反应为2Cu2++4I-=I2+2CuI↓)。
③用电感耦合等离子体发射光谱仪测定反应后溶液中c(Cu2+)=0.0125 mol·L-1。
根据上述实验数据,计算卤水样品中I的含量(单位mg·L-1 , 溶液混合前后总体积变化不计,写出计算过程):。
利用1:淡水工业

①淡水在室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是。

利用2:提溴工业

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2 , Br2歧化为Br-和BrO3- , 再加入W溶液得到Br2。推测W是。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2 , 若总提取率为60%,则原海水中溴的浓度是 mg/L。
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全。
向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是,过滤NH4Cl晶体后的滤液可以再次循环使用。