反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
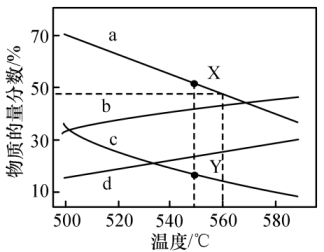
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )


压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
下列说法一定正确的是( )

| 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法正确的是( )

主反应:
副反应:
向装有催化剂的密闭容器中充入体积比为1∶4的与
混合气体,其他条件一定,反应相同时间,测得
和
的转化率、
和CO的选择性与温度的关系如下图所示。

的选择性
CO的选择性
下列说法正确的是
i.
ii.
和
的分压随时间变化如下图所示,其中第3min时只改变了影响反应的一个条件。
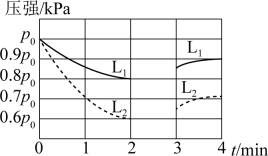
已知:可以用分压表示反应速率及化学平衡。
下列说法错误的是( )

容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间/min | 达平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热 0.1a kJ |
② | 恒压 | 1 | 3 | 0 | t | 放热b kJ |
下列叙述正确的是( )
| 容器1 | 容器2 | 容器3 | |
| 反应温度/K | 700 | 700 | 800 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
| 平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是( )
| 容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
| HCl | O2 | Cl2 | H2O | |||||
| I | 恒温恒容 | 1L | | 4 | 1 | 0 | 0 | 1 |
| II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
| III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )

已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。

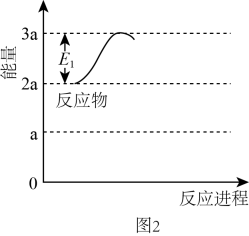
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
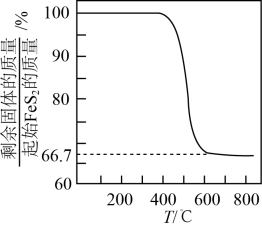
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
I.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH1
II.2NH3(g) +2O2(g) N2O(g)+3H2O(g) ΔH2
III.4NO(g) 2N2O(g)+O2(g) ΔH3
①ΔH1、ΔH2、ΔH3之间的关系式为ΔH3=。
②达到平衡时,容器中含有a mol NO和b mol N2O,此时H2O(g)的浓度为mol·L-1。(用含a、b、V的代数式表示,下同),该温度下反应III的平衡常数为L·mol-1。

①若保持容积不变,t1时反应达到平衡,用N2的浓度变化表示0~t1时间内的反应速率v(N2)=mol· L-1·min-1(用含t1的代数式表示);
②若t2时将容积迅速增大至原来的2倍并保持不变,则图中能符合题意表示容积增大后H2分压变化趋势的曲线是(用a、b、c、d表示),理由是。
③若t2时保持容积不变再充入0.1 mol NH3 , 则化学平衡将(填“正向移动”“逆向移动”或“不移动”),再次达到平衡时,与t1时相比,NH3的体积分数(填“变大”“变小”或“不变”)
|
共价键 |
C-H |
C-O |
|
H-H |
O-H |
|
键能( |
413 |
358 |
839 |
436 |
467 |
由此可估算反应的焓变
。

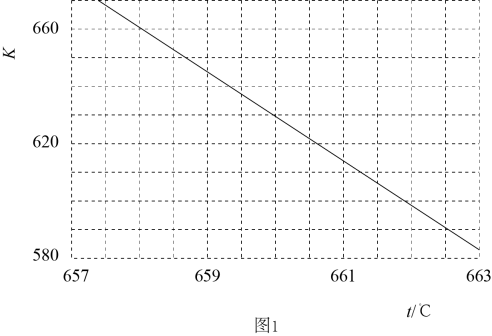
①压强(填“>”“<”或“=”,下同)。判断依据是。
②a、b两点的平衡常数。
③已知Arrhenius经验公式为(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=
。从图中信息获知催化效能较高的催化剂是(填“m”或“n”)。

I.(主反应)
II.(副反应)
I的反应历程可分为如下两步:
①(反应速率较快)
②(反应速率较慢)


4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1 , 则其正反应活化能为kJ•mol-1 (用含E逆的代数式表示)。
②2NOCl(g)2NO(g)+Cl2(g)
③I2(g)+Cl2(g)2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为。

用方程式表示 N2O在Pt2O+ 表面上的反应。


已知:①为磷酸酯萃取剂(密度小于水);②
易水解。
请回答下列问题:
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq)+NaOH(aq) =NaF(aq) +H2O(l)的ΔH=。

若固定隔板于“5”处,当右侧容器内反应2HF(g)⇌(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2 , 则P1P2(填“大于”“小于”或“等于”)。该温度下,2HF(g)⇌(HF)2(g) 反应的平衡常数KP=kPa-1(KP为以分压表示的平衡常数,计算结果保留2位有效数字)。

图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是。


①图中A转化为B的过程中发生反应的化学方程式为
②实验室中证明得到的是纳米材料的方法是
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
|
化学键 |
O-H |
H-H |
C=O |
C≡O( CO) |
|
键能/(kJ·mol -1) |
463 |
436 |
803 |
1075 |
则ΔH3=,若反应III的正反应活化能Ea(正) =83 kJ· mol-1 , 则逆反应活化能Ea(逆)= kJ·mol-1。
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是。

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是(填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度

压强p1、p2、p3由大到小的顺序是,CH4的平衡转化率随温度升高而增大的原因是。

空气反应器与燃料反应器中发生的反应分别如下:
反应1:2Cu2O(s)+O2(g) 4CuO(s) △H1=-292 kJ·mol - 1
反应2:20CuO(s) +C3H8(g) 10Cu2O(s) + 3CO2(g) +4H2O(g) △H2
反应3:C3H8(g) +5O2(g)=3CO2(g) +4H2O(g) △H3=-2044 kJ·mol-1
请回答下列问题:
①温度不变,将容器体积扩大至原来的2倍且不再改变,达到新的平衡时,气体压强p(O2)= kPa。
②当Cu2O的质量不变时, (填“ 能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量O2 , 平衡(填“向正反应方向”“向逆反应方向”或“不”)移动,达到新平衡之后,O2的平衡转化率 (填“增大”、“减小”或“不变”)。

①随着投料比[]增大 ,C3H8的平衡转化率减小的原因是。
②在上述温度下,平衡常数Kp= (kPa)6(以分压表示 ,列出计算式即可。分压=总压×物质的量分数)。
Ⅰ. ![]() (g)
(g)
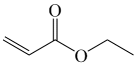 (g)+H2O(g) ∆H1>0
(g)+H2O(g) ∆H1>0
Ⅱ.  (g)+NH3(g)
(g)+NH3(g) ![]() (g)+H2O(g)+
(g)+H2O(g)+ ![]() (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
化学键 | ||||||
键能( | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算。
 ×100%)。
×100%)。
①![]() 的名称为(用系统命名法命名)。
的名称为(用系统命名法命名)。
②随着温度的升高, 的平衡体积分数先增大后减小的原因为。
的平衡体积分数先增大后减小的原因为。
③图中A点对应反应Ⅱ的标准平衡常数(保留两位有效数字)。【其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为
)除以
】
④实际生产中若充入一定量氨气可提高丙烯腈的平衡产率,原因为。
 (g)
(g)

通电过程中,石墨电极2上的电极反应式为。