 下列分析错误的是( )
下列分析错误的是( )
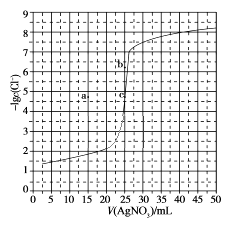


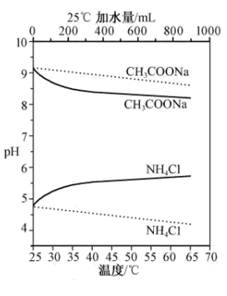

| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将石蜡油催化分解产生的气体通入酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 该气体为乙烯 |
| B | 向NaAlO2溶液中持续通入气体Y | 先出现 白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| C | 向等量同浓度的H2O2溶液中分别加入CuCl2、FeCl3溶液 | 加FeCl3溶液的H2O2产生气泡较快 | Fe3+对H2O2分解的催化效果较好 |
| D | 取CH3OONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |

选项 | 实验操作 | 现象 | 解释或结论 |
A | 向2mL 0.1mol·L-1Na2S溶液中滴加0.1mol·L-1Zn SO4溶液至不再有沉淀产生,再滴加几滴0.1mol·L-1CuSO4溶液 | 先产生白色沉淀,又出现黑色沉淀 | Ksp (ZnS) >Ksp(CuS) |
B | 将少量铜粉加入稀硫酸中,无明显现象,再加入硝酸铁溶液 | 铜粉溶解 | Fe3+与铜粉反应 |
C | 将25℃0.1mol·L-1的Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高,SO |
D | 取2mL某卤代烃样品于试管中,加入5mL 20%KOH溶液并加热,冷却到室温后加入足量稀硝酸再滴加AgNO3溶液 | 产生白色沉淀 | 该卤代烃中含有氯元素 |
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的 | 证明 |
B | 向3 | 检验醛基 |
C | 等体积 | 证明 |
D | 向10 | 证明在相同温度下 |

甲同学设计实验方案如下(表中溶液浓度均为):
i.实验和(填序号),探究加水稀释对水解程度的影响;
ii.实验1和3,探究加入对
水解程度的影响;
iii.实验1和4,探究温度对水解程度的影响。
序号 | 温度 | ||||
1 | 25℃ | 40.0 | 0 | 0 | |
2 | 25℃ | 4.0 | 0 | 36.0 | |
3 | 25℃ | 20.0 | 10.0 | ||
4 | 40℃ | 40.0 | 0 | 0 |
①根据甲同学的实验方案,补充数据:。
②实验测得 , 该结果不足以证明加入
促进了
的水解。根据(填一种微粒的化学式)的浓度增大可以说明加入
能促进
的水解。
③已知水解为吸热反应,甲同学预测
, 但实验结果为
。实验结果与预测不一致的原因是。
查阅资料: ,
为
溶液起始浓度。
试剂:溶液、
盐酸、
计。
实验:测定40℃下水解常数
, 完成下表中序号7的实验。
序号 | 实验 | 记录的数据 |
5 | 取 | 消耗盐酸体积为 |
6 | 测40℃纯水的 | |
7 |
在50℃和60℃下重复上述实验。
数据处理:40℃,(用含
、
、
的计算式表示)
实验结论: , 温度升高,促进
水解。

已知:
金属离子 | Fe3+ | Fe2+ |
开始沉淀时(c=0.01 mol·L-1)的pH | 2.2 | 7.5 |
回答下列问题:
①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。

氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO- , 消耗OH-mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为。

2Fe3++Sn2++6Cl-=2Fe2++SnCl62-
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在滴定管中 (填“酸式”、“碱式”);若不加HgCl2 , 则测定的Fe3+量 (填“偏高”、“偏低”或“不变”)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:。
b.沉淀:。
c.分离,洗涤。
d.烘干,研磨。
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:,你预测的理论依据是(用离子方程式表示):。
配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:。

②测溶液的pH得知溶液呈酸性,其原因是: (用离子方程式表示)。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:。
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:。
将等体积、低浓度的溶液(已用稀盐酸酸化)和
溶液混合,静置至体系达平衡,得红色溶液a。各取
溶液a放入3支比色皿中,分别滴加
不同浓度的
溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
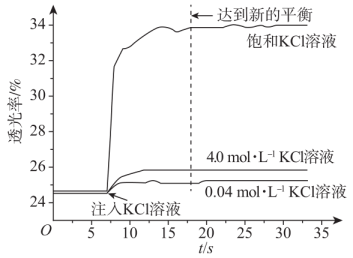
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②在水溶液中由于水解而显黄色;
溶液中存在
(黄色)。
稀盐酸酸化溶液的目的是。采用浓度较低的
溶液制备
和
平衡体系,是为了避免(填离子符号)的颜色对实验干扰。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。溶液的加入使
和
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 , 离子浓度发生变化,导致
和
平衡状态发生变化。
基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 | 加入少量盐 | 溶液颜色 |
1 | 无 | 红色 |
2 | 变浅 | |
3 | 略变浅 | |
4 | 变浅程度较大 |
①上述实验可证明盐效应影响了和
平衡体系的是(填字母序号)。
a、1和2 b、1和3 c、1和4
②选择实验(填序号)可得出结论:的盐效应弱于
的盐效应。简述选择实验的理由及获得结论的依据:。
序号 | 加入溶液 | 溶液颜色 |
5 |
| 明显变浅,溶液偏黄 |
6 |
| 略变浅 |
上述实验可证明副反应影响了和
平衡体系,结合实验现象及化学用语分析副反应对
和
平衡体系有影响的原因:。
在不同浓度
溶液中的溶解度数据如下表:
0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 | |
| 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
分析在
范围内,
溶解度发生变化的原因:。
序号 | 实验操作 | 实验现象 |
Ⅰ | 取20mL“84”消毒液和40mL医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
结论一:“84”消毒液能与酒精发生化学反应,二者不能混合使用。
结论二:该反应为放热反应。
乙同学认为要得出结论二还需补充两个实验,请简要写出实验方案。
实验Ⅱ:;
实验Ⅲ:。