
下列说法正确的的是( )
 下列分析错误的是( )
下列分析错误的是( )
实验 | 实验操作和现象 |
1 | 常温下,向4 mL 0.01 mol·L-1的KMnO4酸性溶液中加入2 mL 0.10 mol·L-1H2C2O4溶液,溶液褪色 |
2 | 常温下,测得0.10 mol·L-1NaHC2O4溶液的pH=a |
3 | 常温下,向0.10 mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4 mol·L-1 |
4 | 常温下,向0.10 mol·L-1Na2C2O4溶液中滴加等浓度盐酸至溶液的pH=7 |
下列所得结论正确的是( )
| 体系pH | 不同温度下 | ||
| 0℃ | 25℃ | 50℃ | |
| 10 | | | |
| 12 | | | |
| 14 | | | |
| 实验 | 实验操作和现象 |
| 1 | 向40mL沸水中滴加几滴FeCl3饱和溶液,继续煮沸,得到红褐色液体,停止加热 |
| 2 | 向5mL略浑浊的泥水中加入2mL明矾饱和溶液,静置,产生絮状沉淀,溶液变澄清 |
| 3 | 将20mLAl2(SO4)3饱和溶液与30mLNaHCO3饱和溶液混合,剧烈反应产生大量气体 |
| 4 | 向5mLNa2CO3饱和溶液中滴加3滴植物油,煮沸,倒出液体后试管壁上无油珠残留 |
下列有关说法错误的是( )
[已知:Ka(HCOOH)=1.8×10-4 , Kb(NH3·H2O)=1.8×10-5]
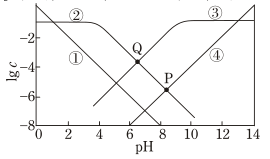


已知:亚磷酸 是二元弱酸,电离常数
,
。


| 选项 | 实验操作和现象 | 结论 |
| A | 在0.1 mol•L-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
| B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
| C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| D | 室温下,用pH试纸测得:0.1 mol•L-1 Na2SO3溶液的pH约为10;0.1 mol•L-1 NaHSO3溶液的pH约为5 | HSO |
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
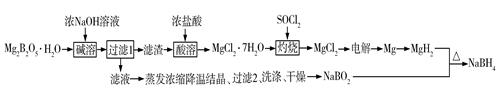
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
①写出正极的电极反应式:。
②若电路中有0.038 mol转移电子时,则溶液pH约为(忽略体积变化,不考虑H2O2电离)。

已知:①饱和 NaClO溶液pH为11;
②25℃时,弱酸电离常数为:H2CO3:K1=4.4×10-7 , K2=4.7×10-11;HClO:K=3×10-8
|
实验步骤 |
实验现象 |
|
|
B瓶 |
C瓶 |
|
|
实验1:取样,滴加紫色石蕊试液 |
变红,不褪色 |
变蓝,不褪色 |
|
实验2:测定溶液的pH |
3 |
12 |
回答下列问题:
①仪器a的名称,装置A中发生反应的离子方程式。
②C瓶溶液中的溶质是NaCl、(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为。
②盖紧瓶塞并在暗处反应的原因滴定至终点的现象。
③C瓶溶液中NaClO含量为g/L(保留2位小数)


(查阅资料)
① ![]()
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
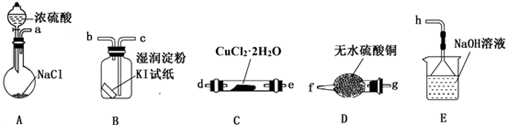
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
25℃,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2 , Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5
第1步:用过量浓氨水吸收SO2 , 并在空气中氧化。
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
25℃,(NH4)2SO3溶液呈(填“酸性”、“碱性”、“中性”)
已知:①2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.0kJ·mo1-1
②2H2(g)+SO2(g) S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
③2CO(g)+O2(g)==2CO2(g) △H3=-566.0 kJ·mol-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mo1-1
写出液态硫(S)燃烧的热化学方程式。
则CO的平衡转化率:NM(填“>”、“<”、“=”,下同);逆反应速率:NP。

原电池法:写出SO2、O2和稀H2SO4所构成的原电池的负极反应式。

①b为电源的(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2 , 目的是。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫Kg。

等浓度的上述四种物质的溶液pH值由大到小的是(用编号填写),选用这些物质中的部分,实现离子反应2H++SO32-→H2O+SO2↑,写出对应的化学方程式。某NaHSO3的浓度为c1 , pH为x1 , NaHSO4溶液的浓度为c2 , pH为x2 , 若x1<x2 , 则c1c2(填“>”或“<“或“=”)。
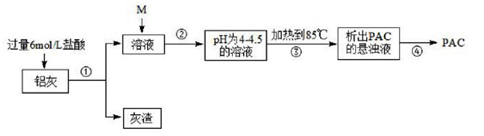
①取样品研碎置于(填仪器名称) 中加热灼烧到质量不再減少, 26.5g 样品最终变为白色粉末10.2g。实验过程中至少进行的称量次数为。
②另取相同质量的样品溶于中,加入足量硝酸银溶液取得沉淀,经洗涤、烘干、称量为28.7g,实验中检查沉淀是否洗浄的方法是。
③列式汁算:x+y=3, =
请写出另一条比例式为。