选项 | 实验操作 | 现象 | 结论 |
A | 向淀粉溶液中加入稀硫酸,加热,一段时间后,冷却,加入NaOH溶液调至碱性,再加入新制的 | 出现砖红色沉淀 | 淀粉已完全水解 |
B | 加淀粉KBr溶液中通入足量氯气,再滴加淀粉KI溶液 | 溶液先变为橙色,后变为蓝色 | 氧化性: |
C | 向等浓度的NaCl和 | 出现白色沉淀(铬酸银为深红色沉淀) | |
D | 向 | 开始时无明显变化,加入铜粉后产生蓝色沉淀 | 氧化性: |



下列说法错误的是

下列说法中错误的是

已知:常温下,Fe(OH)2的Ksp=-8.1×10-16;强碱性溶液中Zn元素主要以的形式存在。
物质 | ||||||
物质下列说法正确的是
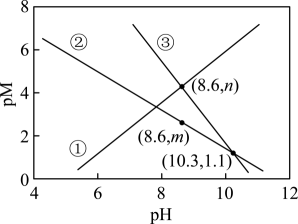
[已知:;
, M为
或
]下列说法正确的是

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)PbCl
(aq) △H>0;Ksp(PbSO4)=1×10-8 , Ksp(PbCl2)=1.25×10-5。下列说法错误的是
选项 | 实验操作及现象 | 实验结论 |
A | 向麦芽糖溶液中加入稀硫酸并加热,再调节pH呈碱性,加入银氨溶液,水浴加热,有银镜产生 | 证明麦芽糖发生了水解 |
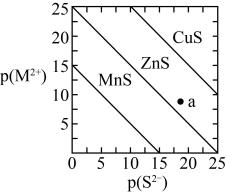
B | 向2份等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解 | 证明 |
C | 某溶液中加盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 原溶液中一定存在 |
D | 向碘水中加入等体积 |
|
选项 | 实验操作 | 现象 | 结论 |
A | 取少量浓硝酸加热分解,将产物先通入浓硫酸,后用集气瓶收集气体 | 将带火星的木条放置瓶内,木条复燃 | 说明 |
B | 向 | 溶液分层,下层呈浅绿色,上层呈紫红色 | 证明还原性: |
C | 室温,取少量铜和浓硫酸反应后的溶液,加入到盛水的烧杯中稀释 | 溶液 | 证明有硫酸剩余 |
D | 向 | 先产生白色沉淀,后生成黑色沉淀 | 溶解度: |
“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
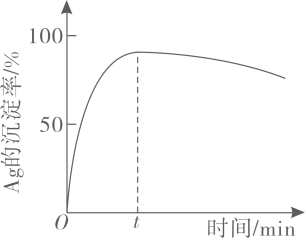
一定温度下,
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。


已知:①长期使用的催化剂,表面会覆盖积碳和有机物;
②Pt溶于王水生成NO和氯铂酸,该酸的阴离子具有正八面体结构,其中铂为正四价;
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 | Al3+ | Mg2+ | Fe3+ |
开始沉淀的pH | 3.5 | 9.5 | 2.2 |
沉淀完全(c=1.0× 10-5mol/L)的pH | 4.7 | 11.1 | 3.2 |
回答下列问题:

由图可知,Pt 浸出的最佳条件为;


已知:
I.“焙烧”后,固体中主要含有、
、
、
;“酸浸”后钒以
形式存在,“中和还原”后钒以
形式存在。
Ⅱ.有机溶剂对四价钒具有高选择性,且萃取
而不萃取
。
Ⅲ.该工艺条件下,溶液中金属离子(浓度均为)开始沉淀和完全沉淀的
如下表所示:
金属离子 | ||||
开始沉淀 | 1.9 | 7.0 | 11.9 | 8.1 |
完全沉淀 | 3.2 | 9.0 | 13.9 | 10.1 |
回答下列问题:



已知:①LiFePO4不溶于碱,可溶于稀酸。
②常温下,Ksp(FePO4)=1.3×10-22 , Ksp[Fe(OH)3]=4.0 × 10-38。
③Li2CO3在水中溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
回答下列问题:

已知: AlF3、LiF难溶于水,LiOH溶于水,Li2CO3微溶于水,Ksp(Li2CO3) 2.5×10-2、Ksp( CaCO3) = 2.8×10-9。回答下列问题:
②已知AlCl3可形成共价分子, AlF3为离子晶体,从电负性的角度解释其原因:。

①“氧化”1 L该废液,需要加入的物质的量为。
②检验已经完全被氧化的方法是。







回答下列问题:
离子 | 浓度(mol·L⁻¹) | 氢氧化物Ksp |
Ni²⁺ | 1.00 | 1.00×10-15.2 |
Co²⁺ | 1.00 | 1.00×10-14.2 |
Mn²⁺ | 1.40 | 1.00×10-12.7 |
a.NiSO₄ b.CoSO₄ c.MnSO₄ d.H₂SO₄
| 实验 | 滴管 | 试管 | 现象 |
I | 10滴0.1mol/L | 等浓度的NaI和 | 黄色沉淀 | |
II | 等浓度的NaI和 | 黄色沉淀 |
①由实验I推测:与结合倾向
(填“>”或“<”)。
②取两等份AgBr浊液,分别滴加等浓度、等体积的和
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中+1价银的存在形式(填化学式)。推测:与
结合倾向
。
的转化
| 实验 | 滴管 | 试管 | 现象 |
III | 0.1mol/L | 0.1mol/L | 白色沉淀,振荡后消失 | |
IV | 0.1mol/L | 0.1mol/L | 白色沉淀,逐渐变为灰色,最终为黑色沉淀 |
①写出实验III中白色沉淀消失的离子方程式。
②查阅资料:实验IV中黑色沉淀是 ,
中S元素的化合价分别为
和+6.写出实验IV中白色沉淀变为黑色的化学方程式并分析原因。
③溶液可用作定影液。向
溶液溶解AgBr之后的废定影液中,加入(填试剂和操作),可使定影液再生。

分析试管1出现银镜的原因。

已知:①N2H4是一种强还原剂,在碱性条件下可将多数金属离子还原成单质。
②Ksp(AgCl)=1.8×10-10 , NaCl在浓硫酸中难溶,Ag2SO4在不同浓度硫酸中的溶解量如下:
硫酸浓度/(mol•L-1) | 18 | 15 | 12 | 9 | 6 | 0 |
硫酸银溶解量/(g•L-1) | 209.00 | 78.94 | 31.20 | 11.14 | 8.74 | 4.68 |
回答下列问题:

已知: As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
物质 | CdS | CuS | PbS |
Ksp | 8.0× 10-27 | 6.3×10-36 | 8.0× 10-28 |