

选项 | 实验操作和现象 | 结论 |
A | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO |
B | 向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 在MgSO4溶液中加入一小块Na,金属Na溶解,并生成固体 | 该固体为Mg |
D | 将浓硫酸滴到蔗糖表面固体变黑膨胀 | 浓硫酸只表现脱水性 |
选项 | 实验操作和现象 | 结论 |
A | 向新制的硫酸亚铁溶液中滴加邻二氮菲( | 邻二氮菲能与亚铁离子形成配合物 |
B | 向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解 | Ag2O是两性氧化物 |
C | 溴乙烷与NaOH的乙醇溶液混合、加热,将产生的气体通入盛有酸性KMnO4溶液的洗气瓶中,溶液褪色 | 反应生成了乙烯 |
D | 向BaSO4固体中加入饱和Na2CO3溶液,过滤,沉淀洗净后加入足量稀盐酸,沉淀部分溶解,且产生气泡 |

选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 摘下几根火柴头浸于水中,一定时间后取适量溶液于试管中,加 | 出现白色沉淀 | 火柴头含有氯元素 |
B | 向 | 绛蓝色溶液 | 牙膏中存在甘油 |
C | 将石蜡油与碎瓷片混合加强热,产生的气体通入酸性重铬酸钾钾溶液中 | 酸性重铬酸钾溶液褪色 | 石蜡油加强热产生的气体是不饱和烃 |
D | 取 | 白色沉淀转化为黄色沉淀 |
|

| 选项 | 实验操作和现象 | 实验结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
| C | 向5 mL 0.1 mol·L-1KI溶液中加入0.1 mol·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
| D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |


该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | | | | | |
| 开始沉淀pH | 1.9 | 7.0 | 8.9 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 10.9 | 4.7 | 10.1 |
下列说法错误的是( )

氧化物( | 产品中 | 产品中Mg杂质含量/% (以 | |||
计算值 | 实测值 | ||||
2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注:ⅰ、浸出率=(浸出的
质量/煅烧得到的
质量)
(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
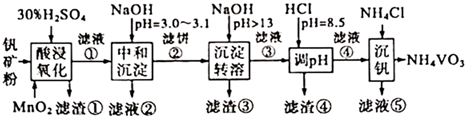
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
|
|
|
|
|
|
|
|
|
|
|
|

A.、
、
B.
、
、
C.、
、
D.
、
、


①写出 水解的离子方程式;
②已知 离子在溶液中也存在类似
的电离平衡,下列有关
氧化
离子生成V2O5·H2O的说法错误的是(填标号)。
A.加入 促使
离子的电离平衡正向移动
B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O

已知:①滤渣I主要成分是难溶于水的Ce(BF4)3;
②常温下,K[Fe(OH)3]=8×10-38 , K[Ce(OH)3]=1×10-22 , lg 2=0.3;
③溶液中离子浓度≤1.0×10-5mol·L-1时视为沉淀完全。
回答下列问题:
|
空气氧化法 |
氧化温度/℃ |
氧化率/% |
氧化时间/h |
|
暴露空气中 |
450~500 |
80 |
14 |
|
对流空气氧化炉中 |
450~500 |
98 |
6 |
在对流空气氧化炉中可大大缩短氧化时间的原因是。

已知:①TiO2难溶于盐酸。
②Ksp[Sc(OH)3]=1.0×10-30 , Ksp[Fe(OH)3]=1.0×10-38


已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

![]()
 +HCOOH
+HCOOH


已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:


 +HCOOH
+HCOOH

回答下列问题:
试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
1-1 | 1 | 分相快 | 90.76 | 15.82 |
1-2 | 2 | 分相容易 | 91.53 | 19.23 |
1-3 | 3 | 分相容易 | 92.98 | 13.56 |
1-4 | 4 | 有第三相 | 90.69 | 30.12 |
1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
料液温度对分离系数的影响如图:


已知:①溶液中的会对电解
溶液造成影响
②与
可以发生反应
③本流程温度下,;
;
请回答下列问题:

物质 | |||
熔点 |
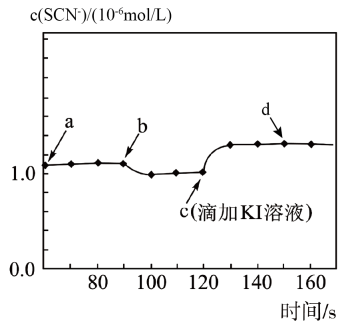
KI溶液和Pb(NO3)2溶液反应,会产生金黄色的PbI2沉淀,形成美丽的“黄金雨”。
①KI溶液在空气中久置会变质,其原因是。
②生成PbI2的化学方程式为。充分反应后,经系列操作得到纯净的PbI2固体,向其中加入蒸馏水,得到PbI2悬浊液。
【查阅资料】ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;
ii.26.5℃时,PbI2饱和溶液的电导率为368μS•cm-1。
稀释对PbI2溶解平衡的影响
26.5℃时,向PbI2悬浊液中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线(图乙)。

①实验装置中仪器X的名称为。
②由电导率变化曲线可知:实验中通过仪器X加入蒸馏水的方式是(填标号)。
A.连续逐滴加入 B.分三次快速放入 C.一次性快速放入
③曲线图中,段(用字母表示,任写一段)表示PbI2固体的溶解达到平衡状态:c→d段溶液的电导率逐渐增大的原因是导致了溶液中离子浓度不断增大。
26.5℃时,将PbI2悬浊液静置后,取200mL上层清液[c(I-)=2.5×10-3mol·L-1]于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入1mol·L-1KI溶液。实验数据记录如表:
KI溶液累计加入量/mL | 电导率/(μS•cm-1) | |
PbI2饱和溶液 | 蒸馏水 | |
0 | 368 | 4 |
0.50 | A1 | B1 |
1.00 | A2 | B2 |
①上述实验过程中,增大PbI2饱和溶液中I-的浓度,可观察到的实验现象是。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为mL。
③表格数据A2-A1B2-B1(填“大于”“小于”或“等于”),说明增大KI的浓度,PbI2沉淀溶解平衡向生成沉淀的方向移动。

已知:电解时,选用2mol·L-1硫酸溶液为电解液。
回答下列问题:
①生成NiS2O3的化学方程式为;该反应可以进行得较完全,结合相关数据说明理由:。
②加入无水乙醇有利于NiS2O3晶体析出,其原因是。