
已知:X2(g)溶解过程发生如下反应:
①X2(aq) +X- (aq)(aq) K1=0.19
②X2(aq) +H2O(1)H+(aq) +X- (aq) + HXO( aq) K2=4.2×10-4
③HXO(aq) H+(aq) +XO- (aq) Ka=3.2×10-8
下列说法正确的是



 , 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是
, 用H2A表示)在生物体内的蛋白质代谢过程中占重要地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1mol•L-1HCl溶液滴定20.00mL0.1mol•L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lgc(OH-)],下列叙述正确的是 


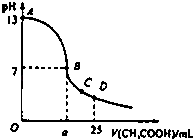
一种煤炭脱硫技术是把硫元素以CaSO4的形式固定下来可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s) +SO2(g)+CO2(g) △H1= +210.5kJ•mol-1
② CaSO4(s)+CO(g)
CaS(s)+CO2(g) △H2=-47.3 kJ•mol-1
反应CaO(s)+ 3CO(g) +SO2(g) CaS(s)+3CO2(g) △H3kJ•mol-1 , 平衡时增大压强,此反应将(填“向正反应方向”、“向逆反应方向”或“不”)移动。
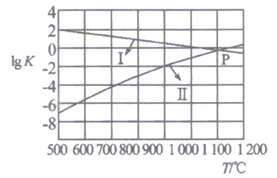
A.低温低压 B.低温高压 C.高温高压 D.高温低压
SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g) +Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
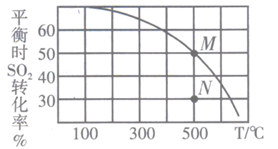
①该反应的平衡常数K(100℃)K(300℃) (填“大于”、“小于”或“等于”);在500℃下,若反应进行至N点,此时v正v逆(填“大于”、“小于”或“等于”)。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
A. 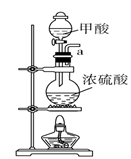 B.
B. 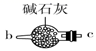 C.
C. 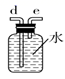 D.
D. 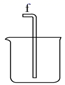
请说出图B中盛装碱石灰的仪器名称。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是;实验时,不需加热也能产生CO,其原因是。
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。

打开k2 , F装置中发生反应的化学方程式为;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是,H装置的作用是。
氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
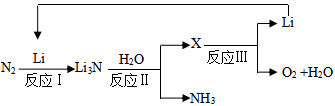
每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。
|
投料比 |
① |
② |
③ |
④ |
|
SO2平衡转化率/% |
97.1 |
96.8 |
95.8 |
90.0 |
②对应的投料比为。投料比为8:10时,平衡混合气体中SO3体积分数为。

吸收池中发生反应的离子方程式是;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为。
合成氨工业中:N2(g) + 3H2(g) 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”)
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2

①该化合物的化学式为

②此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为,其中配位体为分子(填“极性”或“非极性”),


已知:Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=7.4×10-14
回答下列问题:
|
离地面高度 |
0.8 |
1.0 |
1.2 |
1.4 |
1.6 |
1.8 |
2.0 |
|
铅的浓度(μg/cm3) |
1.10 |
0.98 |
0.91 |
0.72 |
0.66 |
0.54 |
0.50 |
①该同学探究的课题名称为。
②分析以上实验数据,可以得出的结论是。
③造成此结果的原因可能是。
![]()
上述实验中如果缺少操作M,所测得结果会 (填“偏大”、“偏小”、或“无影响”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式。

①b点时,平衡体系中C、N原子个数之比接近;
②a、b、c三点CO的转化率从大到小的顺序为;a、c、d三点的平衡常数从大到小的顺序为。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为。
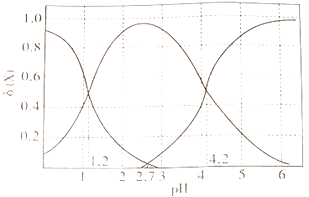
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为(填标号)。
A.强酸性
B.弱酸性
C.中性
D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=。
I.NH4+含量的测定
采用蒸馏法,蒸馏装置如图所示.

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入圆底烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,加热蒸馏;
④用0.120mo l•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶.
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X于烧杯中,加水溶解,边搅拌边加入过量的 BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重.得沉淀质量69.90g.
步骤①中,判断 BaCl2溶液已过量的实验操作和现象是。