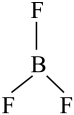
 (平面三角形)
D .
(平面三角形)
D . 

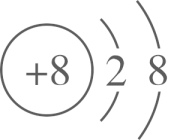 B . 基态铜原子价电子的轨道表示式:
B . 基态铜原子价电子的轨道表示式: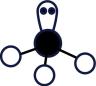 (正四面体形)
D .
(正四面体形)
D .  B . 基态Fe原子最高能级的轨道形状为哑铃形
C . 第一电离能最大的是As
D . 电负性最大的是O
B . 基态Fe原子最高能级的轨道形状为哑铃形
C . 第一电离能最大的是As
D . 电负性最大的是O
 C . 基态Cr原子的价层电子排布式:3d54s1
D . HCl分子中σ键的形成:
C . 基态Cr原子的价层电子排布式:3d54s1
D . HCl分子中σ键的形成:



①CO分子作为配体时,碳原子和氧原子均能够提供孤电子对。CO与钴形成配位化合物时,提供孤电子对的为原子(填元素名称)。
②高氯酸六氨合钴(II)的结构为 。其外界离子的空间构型为;下列对[Co(NH3)6]2+的中心原子采取的杂化类型判断合理的是(填标号)。
。其外界离子的空间构型为;下列对[Co(NH3)6]2+的中心原子采取的杂化类型判断合理的是(填标号)。
A.sp3 B.sp3d C.sp3d2 D.dsp2
①写出一种与N2O互为等电子体的阴离子的化学式:。
②CH3OH与水任意比互溶,其原因除与水分子的极性相似外,还有。

①甲图所示的堆积方式中,每个晶胞中实际占有的钴原子数为;乙图所示的堆积方式中,晶胞的原子空间利用率为。
②已知:NA为阿伏加德罗常数的值,钴原子半径为r pm。甲图中正六棱柱的高为hpm,则该晶胞的密度为g·cm-3(用含r、h、NA的式子表示,列出计算式即可)。


晶胞中的个数为。已知
的摩尔质量是
, 阿伏加德罗常数为
, 该晶体的密度为
。
| 物质 | 熔点/℃ |
| | 800.7 |
| | |
| | |
| | |
与
均为第三周期元素,
熔点明显高于
, 原因是。分析同族元素的氯化物
、
、
熔点变化趋势及其原因。
的空间结构为,其中
的轨道杂化形式为。

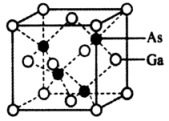
含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
A. B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。

①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
,
),则B原子的坐标为。


![]()


①阿伏加德罗常数的值为NA , 则该晶体密度为g·cm-3.(用含a,NA的表达式表示)。
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,Ni-N键中离子键成分的百分数小于Ni-O键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为,第一电离能铝(填“大于”、“等于”或“小于”)镁,镁原子核外有种不同运动状态的电子。

钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式。

①基态氮原子的电子排布图为。
②上述涉及的元素H、B 、C、N、O中电负性最大的是(填元素符号)。

①上述三种物质中,沸点最高的是(填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是(填“①”或“②” )号氮原子。


①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
①的一种配合物的化学式为
, 其中
原子的配位数为,
中C原子的杂化类型为。
②均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
元素 | |||
电离能 | 717 | 759 | |
1509 | 1561 | ||
3248 | 2957 | ||
锰元素位于第四周期第VIIB族。比较两元素的 , 可知,气态
再失去1个电子比气态
再失去1个电子难,对此你的解释是。

①![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是。
中所有原子均共面,其中氮原子较易形成配位键的是。
②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3 , 配体SCN-中提供孤电子对的原子是(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
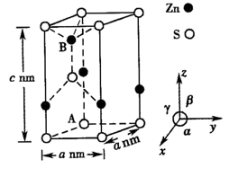
①该晶体中,锌的配位数为。
②已知空间利用率 , 设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为。

回答下列问题:

 或
或 (已略去位于正八面体中心的Cr)
C . ②中存在的化学键有离子键、共价键、配位键和氢键
D . 等物质的量的①②③分别与足量
(已略去位于正八面体中心的Cr)
C . ②中存在的化学键有离子键、共价键、配位键和氢键
D . 等物质的量的①②③分别与足量