化学键 | |||||||
键能/ | 411 | 318 | 799 | 358 | 452 | 346 | 222 |
选项 | 事实 | 解释 |
A | 稳定性:HF>HI | HF分子间存在氢键,HI分子间不存在氢键 |
B | 键角:NH | 中心原子均采取sp3杂化,孤电子对有较大的斥力 |
C | 熔点:石英>干冰 | 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强 |
D | 酸性:CF3COOH>CCl3COOH | F的电负性大于Cl,F-C的极性大于Cl-C,使F3C-的极性大于Cl3C-的极性 |

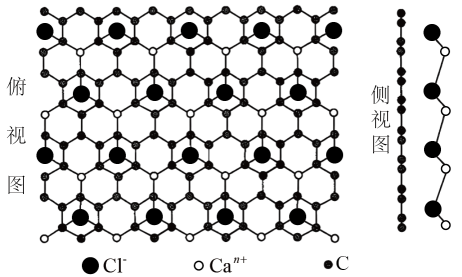
等产物在化工生产中都有广泛用途。下列有关
的说法正确的是( )

下列说法错误的是( )

已知:R、R′代表烷基。
下列说法不正确的是( )
 发生上述反应生成
发生上述反应生成
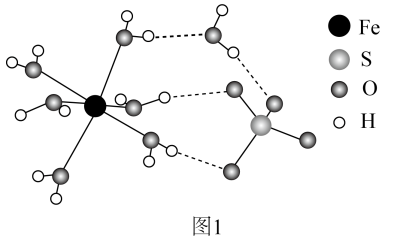
①的价层电子排布式为。
②中O和
中S均为
杂化,比较
中
键角和
中
键角的大小并解释原因。
③中
与
与
的作用力类型分别是。
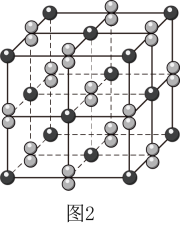
①距离最近的阴离子有个。
②的摩尔质量为
, 阿伏加德罗常数为
。
该晶体的密度为。

①在(CH3)3SiCl、(CH3)3SiF、(CH3)4Si中,C-Si-C键角最大的是,原因是。
②C5H表示环戊二烯负离子,已知分子中的大π键可用符号π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
),则C5H
中的大π键应表示为。
③该铁的配合物中碳原子的杂化方式共有种。

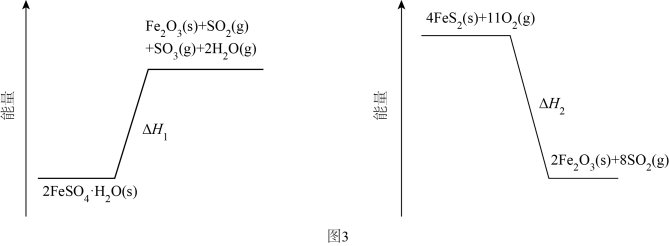
①普鲁士蓝中Fe2+与Fe3+个数之比为;该晶胞的化学式为。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为pm;该晶体的密度为g•cm-3(阿伏加德罗常数为NA)。

②南开大学某课题组成功合成了无机二茂铁类似物[Fe(η4- P4)2]2-。环状是芳香性π配体,P的杂化方式是 ,
中的大π键应表示为(分子中的大π键可用符号
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)


②铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为a pm,阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。



②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO的空间构型为,TeO
中碲原子的杂化类型是。
③H2O、H2S、H2Se、H2Te的键角依次(填“变大”、“变小”或“不变”)。

Cu+填充了晶胞中四面体空隙的百分率是,S2-配位数为。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为。若晶胞参数a nm,晶体的密度为d g·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。
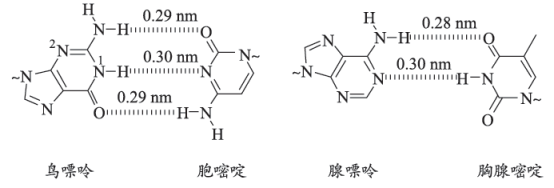
①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。




①其中C、N、O、Zn元素的第一电离能大小关系是,结构中参与sp3杂化原子有个。
②配位键①和②相比。较稳定的是;键角③键角④(填“>”、“<”、“=”)。

①图a纤锌矿型ZnO晶体中O2-的配位数为。
②闪锌矿型中Zn2+填入O2-所形成的“正四面体”空隙中,闪锌矿晶胞中含有个“正四面体”空隙。
③图b闪锌矿型晶胞密度为ρg/cm3.则Zn2+与O2-的距离为nm。(设NA为阿伏加德罗常数的值)

①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素( ![]() )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。

根据图中信息,可计算O2晶体密度是g·cm-3。