| | | | |
| 可用于收集Cl2或NH3 | 蒸发结晶得NaHCO3 | 除去HCl中少量SO2 | 验证非金属性:N>C>Si |
| A | B | C | D |
| 实验器材 | 相应实验 | |
| ① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| ② | 烧杯、分液漏斗 | 用饱和 |
| ③ | 量筒、玻璃捧、烧杯、 | 用浓盐酸配制 |
| ④ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
| ⑤ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到 |
已知: 。
| | | | |
| A.制取 | B.收集 | C.滤去不溶物 | D.制得 |
| | | | |
| A.蒸发结晶制备 | B.分离苯和溴苯 | C.实验室制取蒸馏水 | D.配制100mL |
 B . 保存液溴
B . 保存液溴  C . 分液,先放出水层,再倒出溴的苯溶液
C . 分液,先放出水层,再倒出溴的苯溶液  D . 进行中和热的测定
D . 进行中和热的测定 
| 苯甲醛 | 苯甲酸 | 苯甲醇 | |
| 沸点/℃ | 178.1 | 249.2 | 205.4 |
| 熔点/℃ | -26 | 121.7 | -15.3 |
| 溶解性(常温) | 微溶于水,易溶于有机溶剂 | ||
下列说法错误的是( )


 B . 稀释
B . 稀释  C . 尾气处理
C . 尾气处理  D . 蒸发结晶
D . 蒸发结晶 

选项 | 描述 | 分析 |
A | “煤饼烧蛎成灰” | 这种灰称为“蜃”,主要成分为Ca(OH)2 |
B | “以火烧之,紫青烟起,乃真硝石(KNO3)” | “紫青烟”是因为发生了焰色反应 |
C | 司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe3O4 |
D | “信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾” | 其中涉及到的操作有结晶 |
选项 | 古代文献 | 记载 | 化学解释 |
A | 《开宝本草》 | “(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成” | 制取KNO3可“煎炼而成”是利用KNO3的溶解度受温度影响不大 |
B | 《格物粗谈》 | “红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。” | 文中的“气”是指乙烯 |
C | 《本草纲目》 | “烧酒非古法也,白元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。” | 文中涉及的操作方法是蒸馏 |
D | 《徐光启手迹》 | “五金入强水皆化、惟黄金不化强水中” | “强水”主要成分是硝酸 |

| 选项 | 描述 | 解释或说明 |
| A | 有硇水者,剪银塊投之,则旋而为水 | 能溶解银的“硇水”可能为硝酸 |
| B | 暮春之初,北海之民即煮海为盐 | “煮海为盐”涉及蒸发结晶 |
| C | 曾青得铁则化为铜 | 曾青的蓝色来自 |
| D | 丹砂烧之成水银 | 金属均可用热分解法冶炼 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含 |
| B | 向溴水中通入某无色气体,溴水褪色 | 该气体可能是CH2=CH2 |
| C | 一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出 | Cu与稀硫酸发生了反应 |
| D | 向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀 | 淀粉没有发生水解 |

| 水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
| 熔点/℃ | 157~159 | -72~-74 | 135~138 |
| 相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
| 相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:


①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
A仪器的名称为。
将上述制备的CuSO4溶液按如图所示进行操作

已知浅蓝色沉淀的成分为Cu2(OH)2SO4 , 试写出生成此沉淀的离子反应方程式。
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

玻璃管2的作用,样品中氨的质量分数的表达式。

已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 2.8 |
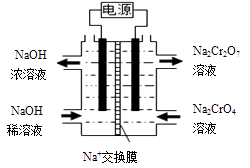
请回答下列问题:

①负极的电极反应式为;
②一段时间后,中间室中NaCl溶液的浓度(填“增大”、“减小”或“不变”)。



为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I- , 起始加入K2CO3必须保持溶液的pH不大于。


①烧瓶中发生反应的离子方程式为。
②由烧瓶中的溶液制取干燥的CoCl2•4H2O,还需经过的操作有蒸发浓缩、、洗涤、干燥等。

①装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置(填“E”或“F”)。
②装置G的作用是;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通氮气的作用是。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6 , 且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为。
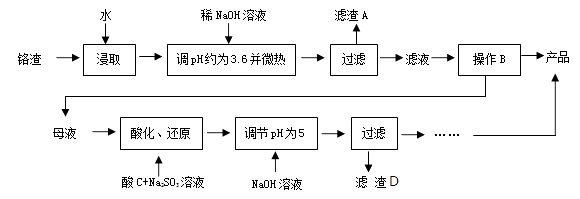
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:

写出两条可提高“酸浸”效率的措施:。
实验步骤:
①称取5.0g绿矾,溶解于水中,配成250mL溶液;
②量取25.00mL待测液于锥形瓶中;
③用0.01mol·L-1的酸性KMnO4标准液滴定至终点,再重复滴定两次,消耗酸性KMnO4标准液的平均体积为35.00mL。
酸性KMnO4标准液盛放在(填“A”或“B”)中。


①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为。
②加还原剂硫脲除去可能含有的
,
共有molσ键。
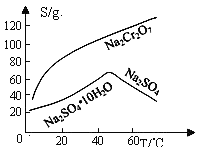
③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取晶体的操作有:在HBr氛围下蒸发浓缩、,,洗涤后烘干。


药品:溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和的离子方程式为。
②设计合理方案,补充完整上述实验步骤:。

已知:①王水是浓硝酸与浓盐酸以体积比1:3形成的混合溶液;
②Au只溶于王水;
③的电离方程式:
。
A.蒸馏水 B. C.70%酒精 D.饱和
溶液
