


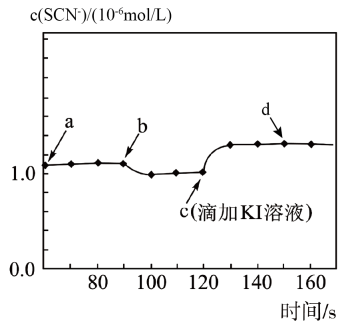

选项 | 实验操作和现象 | 结论 |
A | 向新制的硫酸亚铁溶液中滴加邻二氮菲( | 邻二氮菲能与亚铁离子形成配合物 |
B | 向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解 | Ag2O是两性氧化物 |
C | 溴乙烷与NaOH的乙醇溶液混合、加热,将产生的气体通入盛有酸性KMnO4溶液的洗气瓶中,溶液褪色 | 反应生成了乙烯 |
D | 向BaSO4固体中加入饱和Na2CO3溶液,过滤,沉淀洗净后加入足量稀盐酸,沉淀部分溶解,且产生气泡 |
|
实验编号 |
反应物组成 |
|
a |
|
|
b |
|
|
c |
|
|
d |
|
|
e |
|
回答下列问题:
①
②
③
则的
。

已知:(i)氧化性:Co3+>>Fe3+。
(ii)CoCO3、Co(OH)2、黄钠铁矾[NaFe3(SO4)2 (OH)6]均难溶于水。
回答下列问题:


已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1 ×10-22 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=7.0×10-15 , Ka(CH3COOH)=1.8×10-5。
回答下列问题:
A.ZnO B.ZnCO3 C.Zn(OH)2 D.Zn5(OH)8Cl2·H2O

微粒 | H2S | CH3COOH | CH3COO- |
浓度(mol·L-1) | 0.10 | 0.10 | 0.18 |
则:处理后的溶液pH=,溶液中 c(Zn2+)=mol·L-1。

沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
沉淀完全的pH | 5.2 | 3.2 | 9.4 | 9.5 | 10.1 |

已知:
I. FePO4、CrPO4、AlPO4、Ni3(PO4)2的Ksp依次为1.3 ×10-22、2.4× 10-23、5.8×10-19、5.0×10-31。
II. Cr及其化合物的性质与铝类似。
回答下列问题:
氧化物( | 产品中 | 产品中Mg杂质含量/% (以 | |||
计算值 | 实测值 | ||||
2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注:ⅰ、浸出率=(浸出的
质量/煅烧得到的
质量)
(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
|
|
|
|
|
|
|
|
|
|
|
|

A.、
、
B.
、
、
C.、
、
D.
、
、

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:


已知:Ksp (CuS)=6×10-36;Ksp(PbS)=9×10-29。
请回答以下问题:


已知:①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
回答下列问题:

已知:“水浸”后滤液中的阴离子主要是、
、
、
和
。
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为g(不考虑空气中水蒸气的干扰)。
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过离子交换柱发生反应:
+Ba(IO3)2=BaWO4+2
;交换结束后,向所得含
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
=2I-+
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为,(列出计算式,无需化简)
已知:①浸出液中含有的阳离子有H+、Co2+、 Fe2+、 Mn2+、 Ca2+、Mg2+、Al3+等。
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:

沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 | 10.9 |

A.1.0-1.5 B.3.0-3.5 C.5.0-5.5 D.6.0-6.5

回答下列问题:
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是(填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
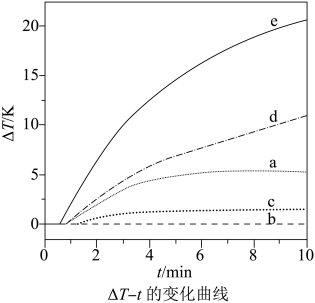
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为mol·L-1(保留2位有效数字)。


①加入的质量约为g时,Cu元素恰好完全浸出。
②当时,Se元素浸出率和浸出渣率均增加的原因是。
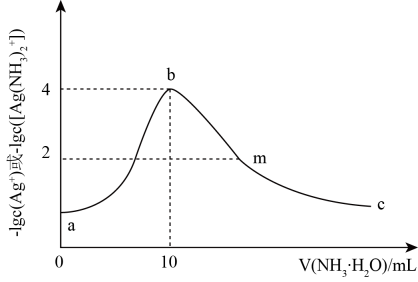
;
则“沉银”时,溶液中时,可使Ag+沉淀完全[即
]。

①正极的电极反应式为;浸金过程中的催化剂是(填化学式)。
②若有标准状况下11.2L参加反应,浸出金的质量为g。