
①向FeSO4溶液中滴加2滴K3[Fe(CN)6]溶液,产生蓝色沉淀,反应的离子方程式为:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
②向次氯酸钙溶液中通入少量的CO2生成白色沉淀,证明Ka2(H2CO3)>Ka(HClO)
③把电石与水反应产生的气体通入酸性KMnO4溶液,紫色褪去,证明有乙炔生成
④向[Cu(NH3)4]SO4溶液中加入95%的乙醇溶液,析出深蓝色晶体,是因为溶液的极性降低,溶质的溶解度减小

方法①:氯化法。以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶。
方法②:熔融法。将铁屑和干燥氯气在低共熔混合物(如30%KCl与70%FeCl3混合)内进行反应生成氯化铁,升华后收集在冷凝室中,该法制得的氯化铁纯度高。
方法③:复分解法。用氧化铁与盐酸反应后得到氯化铁溶液。
方法④:氯化亚铁合成法。将铁屑溶于盐酸中,然后向其中通入氯气得到氯化铁。
下列说法正确的是( )

已知:①CuCl2+Cu=2CuCl↓(白色)速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是( )
①生成FeCO3沉淀的离子方程式为。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。

回答下列问题:
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
|
电对(氧化型/还原型) |
|
|
|
|
|
|
电极电势 |
0.771 |
1.776 |
0.695 |
1.224 |
0.536 |
回答下列问题:
催化
分解反应过程包括i、ii两步:
反应i: (未配平)
反应ii:
反应i的离子方程式为。
用可逆反应设计电池,按图a装置进行实验,测得电压E(
)随时间t的变化如图b所示:

电池初始工作时,正极的电极反应式为。
猜想1:增大,
的氧化性减弱,正极的电极电势降低。
猜想2:减小,
的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
|
实验 |
实验操作 |
电压E/V |
结论 |
|
i |
往烧杯A中加入适量Fe |
E0 |
猜想1成立 |
|
ii |
往烧杯B中加入适量 |
E<0 |
猜想2成立 |
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
|
实验 |
实验操作 |
电压E/V |
结论 |
|
iii |
往烧杯A中加入适量 |
E<0 |
猜想1成立 |
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
实验 | 操作 | 现象 |
Ⅰ | 取少量 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝 |
Ⅱ | 在稀硫酸酸化的 | 无色溶液变紫红色溶液 |
①实验Ⅱ中发生反应的离子方程式为。
②结合上述实验及所学知识,在酸性条件下,、
、
的氧化性由强到弱的顺序是。(填化学式)。
③结合上述流程中“氧化”步骤中发生的反应,说明和
的氧化性相对强弱不一致的主要原因是。

已知:①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②该条件下:Ksp[Fe(OH)3]=1.0×10-38 ,Ksp[Cu(OH)2]= 1.0×10-20 ,Ksp[Mn(OH)2]=1.0×10-14。
回答下列问题:


部分阳离子以氢氧化物形式沉淀时溶液
|
沉淀物 |
|
|
|
|
|
完全沉淀的 |
3.7 |
9.6 |
9.2 |
5.2 |
回答下列问题:

|
金属离子的氢氧化物 |
Ni(OH)2 |
Fe(OH)3 |
黄铵铁矾 |
|
开始沉淀pH |
7.2 |
2.7 |
1.3 |
|
沉淀刚好完全pH |
9.2 |
3.7 |
2.3 |
“深度沉铁”中通入NH3调节溶液pH的范围是。

根据以上实验及图中数据确定黄铵铁矾的化学式为。

试回答下列问题:


已知:i.当微粒浓度低于10-5mol·L1时,认为溶液中不存在该微粒;
ⅱ.常温下,部分难溶物的溶度积常数如下表:
| 难溶物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| Ksp | 1×10-38 | 1×10-16 | 2×10-13 | 2×10-25 |
回答下列问题:

a.KSCN溶液 b.K3[Fe(CN)6] c.酸性高锰酸钾 d.苯酚

有关物质性质如下表
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
| 两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有31.8 g FeCO3和200 mL 2.0 mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
II.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(实验方案)

(实验装置)(制引火铁)

回答下列问题:
工业ZnO 浸出液
滤液
滤液
滤饼
ZnO
提示:在本实验条件下,Ni2+不能被氧化;高锰酸钾的还原产物是MnO2。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Ni2+ | Zn2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.4 | 6.5 |
| 完全沉淀 | 3.7 | 9.6 | 8.4 | 8.5 |
回答下列问题:

已知几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
请回答下列问题:
| 实验方案 | 实验现象 |
| | i.溶液先变黄色,迅速变为棕色 ii.将棕色溶液加热,颜色变浅,冷却 |
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
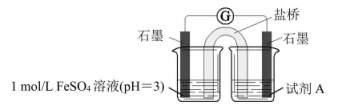
①右侧烧杯中试剂A是。
②实验证据是。
该废铁皮的化学多元素分析结果如下表所示。
|
化学成分 |
FeO |
Fe2O3 |
Fe |
CaO |
CaSiO3 |
其他(C、S等) |
|
含量(%) |
47.35 |
41.92 |
1.07 |
2.64 |
3.48 |
2.68 |
制备流程如下图所示。

|
Fe(OH)2 |
Fe(OH)3 |
|
|
开始沉淀时 |
6.3 |
1.5 |
|
完全沉淀时 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
加入氨水以控制溶液的pH在(选填序号)。
a.3-5 b.6-8 c.9-10
资料:
i.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色) + nH2O [Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
ii.[FeCl4(H2O)2]-为黄色。
进行实验:
(实验I)

(实验II)
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。


图1 Fe(NO3)3溶液透光率随温度变化曲线 图2FeCl3溶液透光率随温度变化曲线
[结论一] FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+
4H2O [Fe(H2O)6]3++ 4Cl- , 得出此结论的理由是。
[结论二] 结论一中反应的ΔH(填“>0”或“<0”)。