



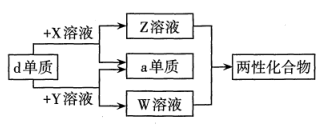
下列说法正确的是( )



 )溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( )
)溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( )





M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号).

a.离子键 b.σ键 c.π键 d.氢键 e.范德华力
①Fe3+的价电子轨道表示式为.
②发生位移的谱线对应的N原子为(填图b中的序号).
③谱线右移的原因为
元素 | Mn | Fe | |
电离能 /kJ•mol﹣1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn元素价电子排布式为,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是.
Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为.

①与CNO﹣互为等电子体微粒的化学式为(写出一种即可).
②氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式.
①水②酒精③煤油
序号 | Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为(用数字填空).
元素 | 元素性质或原子结构 |
X | 原子的最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
T | 与Z同周期,元素最高价是+7价 |
W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示

请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段:.
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显价,B元素的核外电子排布式为。
共价键 | C-C | C-N | C-S |
键能/ kJ·mol-1 | 347 | 305 | 259 |
实验证明:KCl、MgO、CaO、TiN这4种晶体的结构
与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
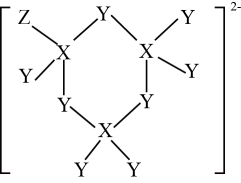
某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

下图是以某富铿卤水(主要含Na+、K+、Li+、Mg2+、Cl一等)进行的沉锂工艺路线图. 
①“二次除镁”所得的沉淀中主要有碱式碳酸镁和
②“沉锂”和“二次除镁”时所用纯碱的浓度差异的原因是
①碳酸锂与硫酸反应的离子方程式是
②结合电极反应式简述制得LiOH的原理:
③该法中可循环利用的物质是.