| 选项 | 实验 | 现象 | 结论 |
| A | 向0.1mol/LFeCl2溶液中加入1滴KSCN溶液,再滴加碘水 | 开始无明显现象,滴加碘水后溶液变红 | 氧化性:I2>Fe3+ |
| B | 向某钠盐中滴加盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐可能为Na2S2O3 |
| C | 乙烯通入中性KMnO4溶液中 | 溶液褪色并产生黑色沉淀 | 乙烯具有还原性 |
| D | 将苯加入橙色的溴水中振荡并静置 | 下层液体几乎无色 | 苯与Br2发生了取代反应 |
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| X | Y | Z | T | |
| L |
| 选项 | 实验操作和现象 | 结论 |
| A | 将NH3通过灼热的CuO粉末,有红色固体生成 | NH3具有还原性 |
| B | 将某溶液滴在KI淀粉试纸上,试纸变蓝 | 原溶液中可能存在I2 |
| C | 向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液,溶液变红 | 氧化性:Fe3+<Ag+ |
| D | 向盛有2mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2mol·L-1的KI溶液,产生黄色沉淀 | [Ag(S2O3)2]3-发生了电离 |
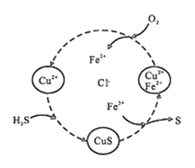
| 化学式 | Na3PO4 | NaH2PO2 |
| 物质类别 | 正盐 | 正盐 |
| 溶液酸碱性 | 碱性 | 中性 |
关于该氧化还原反应的判断正确的是( )



②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。

计算曲线a的反应在30~90 min内的平均速率 (a)=kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是、。489 ℃时PH2和PCO随时间变化关系的曲线分别是、。
| 过程(2)中溶液含有的离子 | 过程(3)中溶液含有的离子 | |
| 甲 | 既有 | 有 |
| 乙 | 有 | 有 |
| 丙 | 有 | 有 |
ClO +VO2++=Cl-+VO
+
a.VO2+ b. c. V2+ d.V
【实验1】通过和
在溶液中的反应比较
和
的还原性强弱。实验操作与现象如下:
在避光处,向溶液中缓慢加入
溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤后得到翠绿色溶液和翠绿色晶体,并留存翠绿色溶液a待用。
已知:Ⅰ.草酸 ()为二元弱酸。
Ⅱ.三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解。其水溶液中存在:
请回答:
A.少量KSCN溶液 B.少量溶液 C.少量HCl溶液
该小组据此判断氧化还原没有发生。请简述未发生氧化还原反应的原因。
①向溶液中加入
溶液,过滤,立即产生黄色沉淀;
②洗涤①中的黄色沉淀(已知:为黄色固体,微溶于水,可溶于强酸),向其中加入过量的
溶液,振荡,静置,反应剧烈放热,产生大量的红褐色沉淀和无色气体;
③待充分反应后,向其中加入稀硫酸,调节pH约为4,得到翠绿色溶液。请回答:
证明被氧化的实验现象是。

用溶液、
溶液和其他试剂,设计图的装置进行实验比较
和
的还原性强弱,一段时间的实验后,该小组依据实验所观察到的现象做出了
比
还原性强的实验结论。则下列实验现象描述能支持这一结论的有:____。(填序号)

元素②位于元素周期表的第周期族,它的一种质量数为14的原子可测定文物年代,用核素符号表示该原子是。
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
|
序号 |
实验① |
实验② |
|
实验操作 |
|
|
|
现象 |
溶液变为黄色 |
|
实验①中反应的离子方程式是。

①热空气吹出溴是利用了(填溴的一种物理性质)。
②写出“吸收”步骤中反应的化学方程式:。氧化性由强到弱的顺序为。
③“分离”操作名称为。
写出步骤②中反应的离子方程式:。
步骤1 向盛有溶液的锥形瓶中加入过量
, 加
酸化一段时间:
步骤2 加入废水,充分反应
;
步骤3 向锥形瓶中加入过量 , 生成的
恰好和
反应。
计算该废水中苯酚的含量(写出计算过程)(已知:)。

操作:向1号和2号试管中,分别滴加适量中性溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力(填“大于”或“小于”)。

查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
仪器a的名称为,D中的NaOH溶液可以用代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO , 则用KOH溶液洗涤的目的是。
②由(4)的实验得出Cl2和FeO的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是。
①在实验1加入H2O2溶液与Fe2+反应的离子方程式是,溶液变红的离子方程式是。

②用实验2探究“红色褪去”的原因,则红色褪去的原因是。

ClO+VO2++_=Cl-+VO
+_
a.VO2+ b. VO+ c. V2+ d.V

①资料涉及的物质中,属于碱的是(填化学式);属于盐的是(填化学式)。
②Cl2与NaOH溶液反应的离子方程式是。
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律:()+()=()+()(填物质类别)。
①该反应中起氧化作用的微粒是。
②若反应中生成了0.01molCl2 , 转移电子的物质的量为mol。