II.CH3CH2CH3(g)+Cl·(g)→(g)+HCl(g)
III.(g)+Cl2(g)→CH3CHClCH3(g)+Cl·(g)
其中,II步反应为决速步骤,能量随反应进程的变化如图,下列说法错误的是( )



选项 | 描述 | 推断 |
A | 碳的燃烧为放热反应,反应焓变为 | |
B | 常温下,将铜、铁用导线连接后插入浓硝酸中,铜片上产生大量气泡 | 铁的金属性强于铜 |
C | 工业上使用催化剂可提高 | 催化剂可改变平衡转化率 |
D | 泡沫灭火器使用时,将硫酸铝和碳酸氢钠溶液两种溶液混合,生成氢氧化铝和二氧化碳的泡沫混合液起灭火作 | 硫酸铝和碳酸氢钠可互相促进水解反应 |
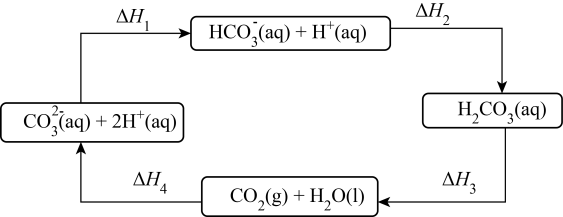


下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、,制得等量H2所需能量较少的是.
①H2S的平衡转化率a1=%,反应平衡常数K=.
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .

①下列说法正确的是 。填序号
A.第Ⅰ步反应的活化能低于第Ⅱ步
B.第Ⅰ步所发生的反应为:
C.使
加氢合成低碳烯烃的
减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂
能提高单位时间内乙烯产量的根本原因是 。
则与
、
的关系表达式为 。
,
填“
”或“
”
。

温度下,平衡时体系的总压强为
。用某气体组分
的平衡分压
分压
总压
物质的量分数
代替物质的量浓度也可表示平衡常数
记作
, 则
用
表示
。

反应Ⅰ: (A)+CH3OH
(A)+CH3OH (TAME) ΔH1
(TAME) ΔH1
反应Ⅱ: (B) +CH3OH
(B) +CH3OH (TAME) ΔH2
(TAME) ΔH2
反应Ⅲ:
 ΔH3
ΔH3
回答下列问题:

①物质A和B中相对稳定的是(用“A”或“B”表示);
②的数值范围是(填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
①平衡体系中B的物质的量为mol,
②反应Ⅰ的平衡常数。
③同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,请判断对反应Ⅰ的化学平衡的影响并说明理由

①代表B的变化曲线为(填“X”或Y”);
②时,判断反应Ⅲ的正反应速率
和逆反应速率
的大小并说明理由
ⅰ.N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ·mol-1;
ⅱ.2NO(g)+O2(g)⇌2NO2(g) △H=-114.0kJ·mol-1;
ⅲ.2NO2(g)⇌N2O4(g) △H=-52.7kJ·mol-1。
回答下列问题:
①下列状态能说明上述反应达到平衡状态的是(填字母)。
a.NO浓度不再变化
b.混合气体的颜色不再变化
c.混合气体的密度不再变化
d.每消耗2molNO2 , 同时消耗1molN2O4。
②若起始时容器内总压强为p1 kPa,10s时容器内3个反应达到平衡状态,此时的总压强和N2O4的分压分别为p2 kPa和p3 kPa;则前10s内N2O4的平均生成速率为kPa·s-1 , 该温度下反应ⅲ的平衡常数Kp=kPa-1。
③若升高温度,平衡体系中NO的体积分数(填“增大”“减小”或“无法确定”),原因为。

①图中代表NO物质的量变化的曲线为。
②T1℃下,N2的平衡体积分数为。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g) C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g) 2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
反应达到平衡后,仅升高温度,k正增大的倍数 k逆增大的倍数(填“>”、“<”或“=”)。
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
物质的量/mol |
0.4 |
0.4 |
0.4 |
此时正、逆反应速率的大小:v正 v逆 (填“>”、 “<”或“=”)。
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136 kJ/mol
②C2H6(g)+ O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | X | 496 |
由此计算x=,通过比较△H1和△H2 , 说明和热裂解法相比,氧化裂解法的优点是(任写一点)。
A.700℃
B.750℃
C.850℃
D.900℃

[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
反应达平衡时,各组分的体积分数如下表:
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
2NH3(g)+CO2(g)⇌CO(NH2)2(I)+H2O(I)△H(I)
2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1
NH2COONH4(s)⇌CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为.

A点的正反应速率v正(CO2) B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为.
温度 | 平衡浓度/(mol•L﹣1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
①T1T2 (填“>”、“<”或“=”).
②下列能说明该分解反应达到平衡状态的是(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
kJ·mol
则H2(g)燃烧生成H2O(l)的热化学方程式为。
①
②
若Q1、Q2均大于零,则Q1和Q2的关系为____(填字母序号)。
|
共价键 |
| | | |
| 断裂1mol化学键所需能量/ | 393 | 460 | 941 | 499 |
和
反应生成
的热化学方程式为。
①若用![]() 、
、![]() 和
和![]() 分别表示N2、H2和NH3 , 则在固体催化剂表面合成氨的过程可用下图表示,其中能量状态最低的是(填字母序号);
分别表示N2、H2和NH3 , 则在固体催化剂表面合成氨的过程可用下图表示,其中能量状态最低的是(填字母序号);

②在三个体积均为1L的恒容密闭容器中,分别加入n1 mol N2和n2 mol H2发生上述反应,实验时c(N2)随时间(t)的变化如图所示。与实验b相比,实验a、实验c分别改变的实验条件可能为、(分别仅改变一个条件)。

①此反应化学平衡常数的表达式为。
②一定温度下,将一定量的Fe2O3(s)和CH4(g)置于恒容密闭容器中反应,能说明反应达到平衡状态的是。
A.混合气体的密度不再改变 B.铁的物质的量不再改变
C.CO和H2的浓度之比为1:2 D.v正(CO)=2v逆(H2)
③一定温度下,向体积为2 L的密闭容器中加入0.2 mol Fe2O3(s)和0.6 mol CH4(g)进行上述反应,反应起始时压强为p,反应进行至5 min时达到平衡状态,测得此时容器的压强是起始压强的倍。5 min内用Fe2O3(s)表示的平均反应速率为
;该温度下反应的分压平衡常数Kp=(用含p的式子表示;已知:气体分压
气体总压
气体体积分数)。
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
①汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),其反应热ΔH=,该反应能自发进行的条件是(填“低温”或“高温”)。
②在恒容密闭容器中发生Ⅳ的反应,下列有关该反应的说法中正确的是(填字母)。
A.升高温度,平衡常数减小
B.体系达到平衡后,加入催化剂,平衡正向移动
C.增大 ,平衡逆向移动,NO的转化率降低
D.其他条件不变,向平衡体系充入CO2气体,K值减小
E.该反应过程中,气体的密度始终保持不变
①阳极电极反应式为。
②阳极附近溶液中除去CN-的离子方程式为。
a.v(C)=2v(B2)
b.容器内压强保持不变
c.v逆(A2)=2v正(B2)
d.容器内的密度保持不变
a.及时分离出C气体
b.适当升高温度
c.增大B2的浓度
d.选择高效的催化剂
S(g)+O2(g)=SO2(g) ΔH2
ΔH1ΔH2
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
ΔH1ΔH2
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2
ΔH1ΔH2