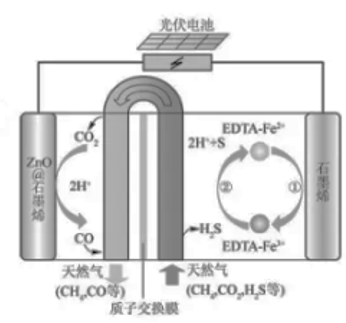
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H₂S=2H++S+2EDTA+Fe²+
该装置工作时,下列叙述错误的是( )



 C . 放电时,电路中每通过NA个电子,负极区质量增加149g
D . 充电时,总反应方程式为:
C . 放电时,电路中每通过NA个电子,负极区质量增加149g
D . 充电时,总反应方程式为: 








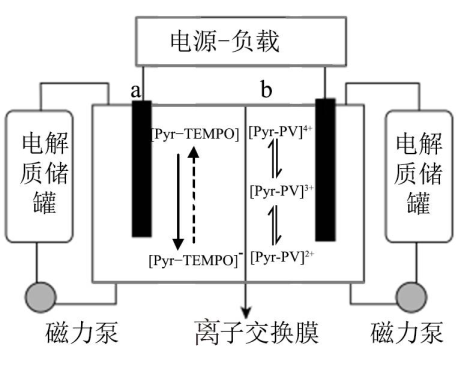

已知:电池工作原理
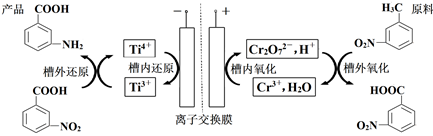
 +Cr2O
+Cr2O  +2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
+2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
 ),电解过程如图所示。下列说法正确的是( )
),电解过程如图所示。下列说法正确的是( ) 
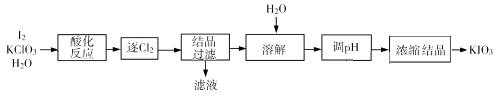
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
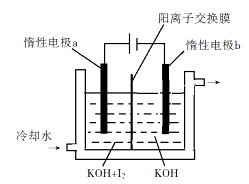
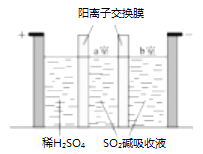
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。
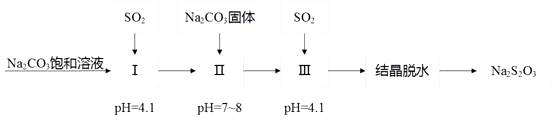 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。
②工艺中加入Na2CO3 , 固体,并再次充入SO2的目的是。
|
物质 |
H2(g) |
CO2(g) |
CH3OH(g) |
H2O(g) |
|
|
0 |
- 393.5 |
- 201 |
- 241.8 |
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH= kJ• mol-1。
②在一定条件下,向恒容密闭容器中充入1 mol CO2和3 mol H2 , 发生反应①,测得在相同时间内,不同条件下H2的转化率如图1所示(在实验条件下催化剂不会失活),b点前L1 高于L2 , b点后L1和L2重合,其原因可能是;T2时,若起始压强为15 atm,Kp=atm-2(结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

③已知速率方程v正=k正c(CO2)·c3(H2),v逆=k逆c(CH3OH)• c (H2O),k正、k逆是速率常数,只受温度影响,图2表示速率常数的对数lgA与温度的倒数之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,点表示a点的lgk正。


①若发生副反应C2H6(g)3H2(g)+2C(s),会降低催化效率,原因是。
②某温度下,若只存在副反应:2CO2(g)+C2H6(g)4CO(g)+3H2(g)。向a L密闭容器中充入2.1 mol C2H6和2.2 mol CO2 , t min后反应达到平衡,容器内C2H4为1.4 mol,CO2为0. 2 mol,则C2H6的平衡总转化率为% (保留三位有效数字)。

富集铜元素
使铜元素与水溶液中的物质分离
增加
在水中的溶解度
循环使用的在反应Ⅰ中的主要作用是.
反应①:
反应②:
总反应③:
反应②的。

①催化剂效果最佳的反应是(填“反应Ⅰ”“反应Ⅱ”、“反应Ⅲ”)。
②一定温度下,下列不能说明上述反应Ⅰ达到化学平衡状态的是。
A.的质量分数在混合气体中保持不变
B.反应中与
的物质的量之比为
C.
D.容器内气体总压强不再变化
E.容器内混合气体的密度不再变化
③若反应Ⅲ在a点时已达平衡状态,a点的转化率高于b点和c点的原因是。
④c点时总压强为0.1MPa,该反应的平衡常数=(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果用最简分式表示)。

①多孔电极a的电极反应式为。
②若生成的和
的物质的量之比为
, 则消耗相同状况下的
和
体积比为。

回答下列问题:
①下列设想的加快浸取反应速率的措施中不合理的是 (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS) :ZnS(s) +Cu2+ (aq) CuS(s)+Zn2+(aq) ,该反应的平衡常数K=。 [已知:Ksp(ZnS)=1. 6×10-24 , Ksp(CuS)=6.4×10-36]
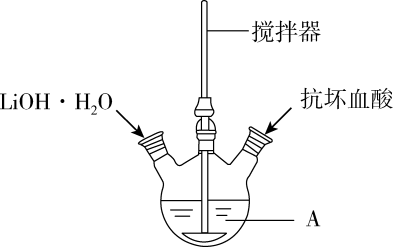
制备步骤:
I.在仪器A中加入40mL蒸馏水、0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌。
II.向反应液中加入少量抗坏血酸(维生素C),继续搅拌5min。
III.快速将反应液装入反应釜中,保持170℃恒温5h。
IV.冷却至室温,过滤。
V.用蒸馏水洗涤沉淀。
VI.干燥,得到磷酸亚铁锂产品。
回答下列问题:
A.50mL B.100mL C.250mL D.500mL
A.Na2SO3 B.铁粉 C.酸性高锰酸钾溶液

编号 | 溶解氧的浓度 | ||||
1 | 50.0 | 0 | 0 | 0 | 8.3~7.3 |
2 | 5.0 | 0 | 45.0 | 0 | 8.3~10.5 |
3 | 5.0 | 5.0 | x | 0 | 8.3~15.0 |
4 | 0 | 0 | 50.0 | 0 | 8.3 |
5 | 0 | 0 | 0 | 50.0 | 8.3~15.5 |
①实验2、3是判断相同浓度在不同
下是否有氧气产生,其中
。
②实验2和5条件下,测得溶解氧的曲线如图中Ⅰ、Ⅱ所示,分析实验2溶解氧先降低后升高的原因是。

③实验3中时间段内溶液溶解氧逐渐增大,电解
后取阳极区溶液
于试管a,加入淀粉
溶液,没有明显现象;然后滴加稀硫酸,溶液变蓝。电解
后另取阳极区溶液
于试管b,加入淀粉
溶液,溶液变蓝。由上述实验现象可获得的实验结论是。
④工业上在一定条件下电解食盐水制备较纯净的 , 除了控制一定的电压,采用活性
电极外,可采取的措施有(写一种)。
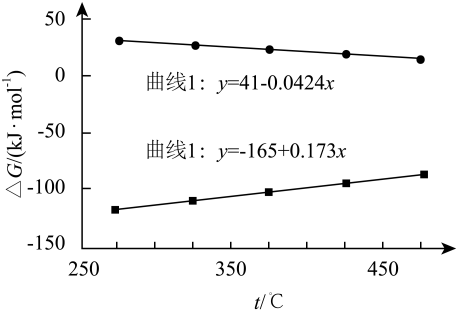

①在工业上,常选用作为合成温度,原因是。
②时
对甲烷的选择性=(保留2位有效数字,已知:选择性=生成
的物质的量/参与反应的
的物质的量),该温度下反应II的
。(保留2位有效数字,已知:分压=组分物质的量分数×总压)

已知:Ksp (CuS)=6×10-36;Ksp(PbS)=9×10-29。
请回答以下问题:

反应Ⅰ:![]() (g)
(g)
反应Ⅱ:
乙烯与在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为。
②M点后曲线下降的原因为。
③下列说法正确的有(填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.催化剂的催化活性与温度成正比
C.不同催化剂达到最高活性时的温度不同

①0(填“>”或“<”)。
②在T℃的恒温、恒容密闭容器中,按体积分数充入反应混合气体:乙烯30%、氧气7%,其余混合气63%(致稳气),发生反应Ⅰ(忽略反应Ⅱ)。平衡时体系压强为2000kPa,乙烯的转化率为 , 则T℃下反应Ⅰ的相对压力平衡常数
。
科学家利用、水合成环氧乙烷,有利于实现碳中和。总反应为:
![]()
, 该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。

①电解槽1中阴极的电极反应式为。
②图四虚线框中发生的反应为:、、
。
已知:PNP的溶解性与苯酚类似,微溶于水;其化学性质稳定,可被•OH、HClO氧化降解为无机物,但不能与O2反应。

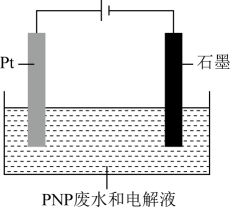
①•OH(氧元素为-1价)由水产生,•OH在(填“Pt”或“石墨”)电极产生。
②产生•OH的电极反应式为。
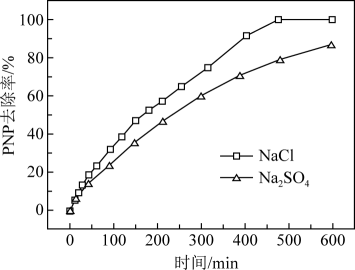
①电解质为NaCl时,阳极副反应的电极反应式为。
②电解质为NaCl时,PNP去除率较Na2SO4高,可能的原因是。